|
Dra. Yadira Freire Osorio
DEFINICION
La micología es una rama de
la microbiología que se dedica al estudio de los hongos; tiene relación con
todas las especialidades médicas. En el área de dermatología revisaremos el
diagnóstico micológico de los hongos que invaden los estratos superiores de la
epidermis, mucosa y anexos como pelos y uñas.
CARACTERISICAS GENERALES DE LOS HONGOS
Son vegetales que carecen de
clorofila, no poseen la propiedad de fotosíntesis y por lo tanto son
heterotropos.
Son eucariotes, presentan un
núcleo bien diferenciado, con membrana doble, bien organizada y nucleolo.
| Publicidad |
|

|
Su organelos citoplasmáticos
incluyen mitocondrias, retículo endoplásmico, vacuolas, ribosomas 80S, aparato
de Golgi, hileras de microtúbulos, glucógeno y corpúsculo de woronin que
tiene la función de obturar los poros de los tabiques en cada micelio.
Tienen una pared celular
formada por polipéptidos, polisacáridos, proteínas, lípidos y quitina.
Su alimentación la hacen
absorbiendo nutrientes simples y solubles que obtienen al desintegrar polímeros
mediante enzimas extracelulares llamadas despolimerasas.
Para su crecimiento y
desarrollo necesitan: sustancias nitrogenadas como peptona; azucares como
glucosa y maltosa; gelosa como soporte sólido que permite a los hongos
filamentosos desarrollar micelio aéreo con órganos de fructificación; ph 5-6;
siendo el medio glucosado o maltosado de Sabouraud el que reúne estas
características.
TALO O
MICELIO
Es el cuerpo o estructura
básica de los hongos, el cual a su vez puede estar formado por múltiples
filamentos o hifas o por estructuras unicelulares o levaduras. Puede ser de 2
tipos:
1.
TALO VEGETATIVO
Que cumple con las funciones
de nutrición, fijación y crecimiento. Estaformado por el talo unicelular y el
talo filamentoso.El talo unicelular esta representado por las levaduras o por
los esporos los cuales tienen un diámetro medio de 6-8 micras y se multiplican
por brotación o por escisión.
El talo filamentoso o hifa
esta constituido por un tubo cilíndrico, de pared celular rígida, de 1 a 30
micras de diámetro que crece por el vértice de cada una de sus ramas. Presenta
tabiques transversales dando lugar a la formación del MICELIO TABICADO
2.
TALO REPRODUCTOR
Que se encarga de la
conservación y diseminación de la especie mediante la formación de células
llamada esporos. La reproducción puede ser asexuada (teleomorfa) o sexuada (anamorfa);
los hongos que presentan ambas formas se llaman holomorfos.Entre el talo
unicelular y el filamentoso hay una formación intermedia llamada SEUDOMICELIO
el cual en determinadas condiciones de cultivo o en las lesiones se ha formado
por BLASTOSPOROS que no se separan.
PROCEDIMIENTOS DIAGNOSTICOS DEL LABORATORIO
PREPARACION
DEL PACIENTE
Es una etapa importante para
reducir al máximo la presencia de microorganismos contaminantes y evitar la
presencia de sustancias extrañas que interfieran en la observación microscópica.
El paciente debe suspender
cualquier tratamiento antimicótico 10 días antes de la toma de la muestra;
igualmente debe abstenerse de aplicar cremas, pomadas, polvos sobre la piel, así
como esmaltes en las uñas, lacas en el cabello por lo menos 5 días antes de la
toma de la muestra
Se recomienda previamente
limpiar el área afectada con alcohol o agua destilada estéril

MATERIALES
Se utiliza hojas de bisturí
con punta roma esterilizadas, cajas de petri, pinzas, láminas portaobjetos,
tijeras pequeñas, cortauñas, cepillos, laminillas cubreobjetos, cinta adhesiva
OBTENCION
DE LA MUESTRA
El material que se obtiene en
la toma de la muestra depende de la zona afectada, así podremos obtener:
ESCAMAS:
Los hongos que ocasionan las micosis superficiales se encuentran en el estrato
corneo de la epidermis por lo tanto hay que tomar y tratar las escamas para
eliminar la queratina y liberar así las estructuras micóticas lo que permite
una optima visualización.
Son recolectadas con una hoja
de bisturí punta roma primeramente introducido en alcohol y luego esterilizado
en la llama, se realiza un raspado de varias lesiones para obtener así la mayor
cantidad posible de material, el cual puede recogerse en una caja de petri o
directamente sobre la lámina portaobjetos. Un excelente material es el que se
obtiene del borde activo de las lesiones, sobre todo en el caso de lesiones
circinadas.
Cuando las lesiones son
eritematosas, húmedas o con exudados, la muestra deberá también tomarse con hoja
de bisturí y si hay vesículas, éstas deberán romperse para recolectar el
material.
Si estamos frente a máculas
hipo o hipercrómicas con sospecha de una pitiriasis versicolor, se debe aplicar
la técnica de la cinta adhesiva, la cual consiste en aplicar un pedazo de cinta
adhesiva transparente sobre las lesiones, presionar un poco y después de unos
segundos retirarla y colocarla sobre una lámina portaobjetos
UÑAS:
Dependiendo del sitio de afección de la uña se tomará la muestra. Si está
localizada en el lecho ungueal (onicomicosis subungueal distal o proximal) o en
la uña misma (onicomicosis superficial blanca), se realiza un raspado profundo
del lecho ungueal o de la lamina afectada, partiendo del extremo distal al
proximal y recolectando el detrito subungueal de la parte incolora, pigmentada,
distrófica y más débil de la uña. Es necesario obtener la muestra en el límite
entre la región sana y la enferma.
PELOS:
En el caso de una tiña capitis o barbae, se toman los pelos cortos, gruesos y
que se extraigan fácilmente con una pinza de depilación; muchas veces las
estructuras fúngicas están en los folículos pilosos. Las escamas del cuero
cabelludo se toman con bisturí.
Es conveniente obtener de 10
a 20 pelos y examinar la zona afectada con luz de Wood en busca de zonas
fluorescentes que indican la presencia de dermatofitos.
Cuando se sospecha la
presencia de piedra negra o piedra blanca se emplea una lupa para escoger
aquellos pelos que presenten nódulos.
EXAMEN
MICROSCOPICO
Para aclarar la capa córnea
de la piel y sus anexos es necesario usar soluciones que disuelven la queratina
(sustancias queratolìticas) sin afectar la morfología de los elementos fúngicos.
Los mas comunes son el KOH
(hidróxido de potasio) en concentración del 10-40%, al que se le puede
adicionar tinta parker negra, dimetilsulfóxido o blanco calcoflúor (su uso
requiere de microscopía de fluorescencia).
La revisión microscópica se
lleva a cabo con lentes de x10 y x 40.
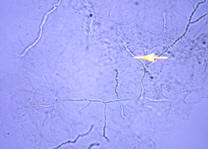
Los dermatofitos en las
muestras de uñas y escamas aparecen como hifas o micelios tabicados, largos,
rectos, de aspecto hialino, con tabiques dispuestos a intervalos regulares de
distancia, ramificados (foto 1). En ocasiones estas hifas se presentan de color
café o verde oscuro, ramificadas, septadas y con extremos delgados, nos
encontramos así ante la presencia de una tiña negra
|
 |
|
1. Hifas o micelios hialinos, tabicados |
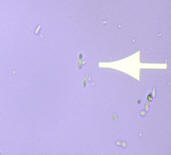
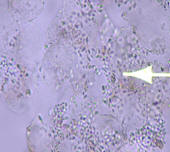
En la Candidiasis los
elementos se presentan en forma de levaduras; levaduras con gemación o brotantes
que constituyen los blastosporos (fotos 2 y 3) y por ser la cándida albicans un
hongo dimórfico se encuentra además la presencia de seudomicelio o seudohifa, la
cual a veces es indiferenciable de la hifa verdadera.
|
 |
|
 |
|
2. Blastosporos x 10 |
|
3. Blastosporos x 40 |
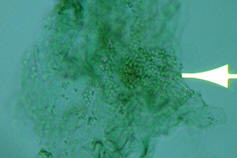
En la pitiriasis versicolor
(producido por M.furfur) se observa acúmulos o racimos de levaduras ovaladas o
redondeadas de 4-8 micras de diámetro,de pared gruesa, acompañadas de micelios
cortos, sinuosos, en forma de s, en ocasiones largos y delgados (foto 4); ambos
elementos pueden presentarse independientemente, pero si lo hacen juntos dan la
imagen típica de “albóndigas y espagueti”.
|
 |
|
4. M.furfur, levaduras y micelios cortos |
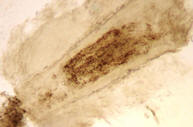
El examen de los pelos en
la tiña capitis endotrix (su agente es el T.tonsurans) nos muestra la
presencia de hifas con esporos parasitando el interior del pelo (foto 5),
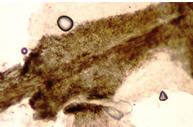
cuyo límite se mantiene intacto. En la tiña capitis ectotrix (agente M.canis)
los esporos o artroconidias se encuentran formando una vaina en la parte
externa del pelo (foto 6). En la forma ectoendotrix se encuentran hifas y
pocos esporos en el interior y abundantes esporos hacia el exterior del
pelo.
|
 |
|
 |
|
5. Pelo con esporos endotrix |
|
6. Pelo con esporos ectotrix |
Los nódulos de Piedra blanca
son de color crema o gris y al microscopio se observan formando una vaina
alrededor del pelo, la cual esta formada por hifas que al fragmentarse dan
origen a artroconidias ovaladas o rectangulares de 2-4 um de diámetro.
Los nódulos de Piedra negra
son estructuras de tipo ascostroma de color café oscuro, de paredes gruesas que
contiene hifas septadas, entrelazadas y que al romperse liberan ascas de 25-55
um, las cuales contienen de 2 a 8 ascosporas en su interior
CULTIVOS
Una fracción de la muestra
obtenida se utiliza para cultivarla. Los medios de cultivo más utilizados son
el agar sabouraud base, agar sabouraud glucosado, al cual se le puede agregar
antibioticos como ciloheximida o cloranfenicol, el DTM que contiene además un
indicador de rojo fenol y el medio mycosel
La temperatura óptima de
crecimiento es de 28 a 30 grados. El tiempo de crecimiento de las colonias esta
entre 4 y 15 días
Se debe estudiar las
características macroscópicas, microscópica y fisiológicas
CARACTERÍSTICAS MACROSCOPICAS
·
Forma y tamaño
·
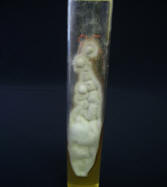
Color en anverso y
reverso,por ej.t. rubrum (foto 7) tiene anverso blanco y reverso rojo
·
Difusión del color
·
Coloración: blanca,
rosada, gris, anaranjada, etc
·
Textura: Yesosa,
terrosa, vellosa, cremosa.granulosa
·
Superficie: Elevada o
plana
·
Aspecto: Radiado (ej.
M. canis), cerebriforme, plegado
·Consistencia: Dura, suave,
firme
|
 |
|
 |
|
7. Características macroscópicas T. rubrum |
CARACTERISTICAS MICROSCOPICAS
·
Examen a través del
tubo
·
Examen de un fragmento
de cultivo
·
Método de la cinta
adhesiva transparente
·
Cultivo en lámina o
microcultivo
CARACTERISITICAS FISIOLOGICAS
·
Estudio del talo:
Presencia de filamentos o levaduras
·
Presencia de esporas
sexuadas
·
Presencia de esporas
asexuadas
·
Estudio del
pleomorfismo
·
Prueba de la ureasa
·
Requerimiento o no de
tiamina
BIBLIOGRAFÍA
1. Arenas R, Micología
Médica Ilustrada. 2ª Ed Mexico: Interamericana,Mc Graw Hill,2003 ; 19-33, 41-57,
61-99
2. Arango M, Castañeda E,
2ª edición Colombia. Micosis humanas. Procedimientos diagnósticos. Exámenes
directos, 2003, 21-45
3. Negroni R,: Lecciones de
Clínica Micológica. Bs As Argentina 1997
4. Lacaz C, Porto E, Costa
Matins JEC. Tratado de Micología Médica. Lacaz 9ª Edición.
Sao Paulo, Brasol:
Sarvier, 2002
5. Weitzman I,
Summerbell R:C. The Dermatophytes.Clinica Microbiol Rev 1995; 8 (2): 240-59
6. Negroni R, Guelfand L, y
Col. Acta bioquímica clinica latinoamericana. Manual de procedimientos para
laboratorio de Micología Médica.Bs.As. Argentina, 1999; 17-36
|