Rosita Aguirre Burgos, MD*
Vanesa Pongo, MD**
Juan Camilo Parra, MD§
Juan Carlos Rueda, MD§¶
Resumen
El glaucoma pigmentario (GP) es un glaucoma de
ángulo abierto secundario a un síndrome de dispersión
pigmentaria que consiste en el acúmulo de pigmento a nivel de la
malla trabecular aumentando la resistencia a la salida del humor
acuoso ocasionando así un deterioro progresivo e irreversible de
las estructuras oculares llevando a la pérdida visual.
Frecuentemente afecta a pacientes varones jóvenes con miopía y
aunque su prevalencia es mayor en raza Caucaucásica, no quiere
decir que en nuestro medio no se presente. Por tanto, es de suma
importancia reconocer y diagnosticar tempranamente para un
tratamiento adecuado. Se ha demostrado que la concavidad del
iris es una característica de esta patología por lo que uno de
los tratamientos propuestos es la iridotomía láser. El propósito
de este artículo es revisar la fisiopatología, clínica,
tratamiento del GP y proporcionarles nuestras
recomendaciones según lo estudiado. [Aguirre
R, Pongo V,
Parra JC, Rueda JC. Glaucoma pigmentario.
MedUNAB 2007; 10:106-109].
Palabras clave:
Glaucoma pigmentario, Dispersión pigmentaria, Iridotomía láser.
Summary
The pigmentary glaucoma is
classified as a secondary open angle glaucoma. Where the cause
is a pigment dispersion syndrome which consists of the heavy
pigmentation at the level of the trabecular meshwork. The
pigment increases the resistance of aqueous outflow causing a
progressive and irreversible deterioration of the ocular
structures contributing to visual loss. The disease tipically
affects young, male, myopic persons and although the prevalence
is in casian race it doesn't mean that in our environment, it is
not presented and therefore early recognition and diagnosis in
order to appropriate treatment is of supreme importance. The
iris concavity is a characteristic sign of this pathology and
therefore the proposed treatment is the laser iridotomy. The
purpose of this article is to revise the pathophysiology,
treatment and to expres our recommendations based on this study.
[Aguirre
R, Pongo V, Parra JC, Rueda JC.
Pigmentary
glaucoma. MedUNAB 2007; 10:106-109].
Key words:
Pigmentary glaucoma,
Pigmentary dispersion, Laser iridotomy
Introducción
El glaucoma
pigmentario (GP) es un tipo de glaucoma secundario de ángulo
abierto, ocasionado por una acumulación de pigmento en la malla
trabecular, con la consiguiente alteración en la salida del
humor acuoso. Se han de distinguir dos entidades diferentes que
representarían en algunos casos diferentes estadíos de la
enfermedad: síndrome de dispersión pigmentaria (SDP) y el GP. Es
así, que el SDP se caracteriza por la triada huso de Krukemberg,
defectos de transiluminación en la periferia media del iris y
pigmentación homogénea en la malla trabecular en exceso. El GP
presenta hallazgos clínicos del SDP y dos o más de las
siguientes características: presión intraocular (PIO) mayor o
igual a 21 mm Hg, daño glaucomatoso del nervio óptico y defectos
del campo visual.1-4
Este tipo de
patología representa del 1 al 1,5 % de los glaucomas en el mundo
occidental. Aunque es más frecuente en raza caucásica, en
nuestro medio la presentación de esta patología no por ser menos
frecuente deja de ser significante, por lo que es necesaria una
valoración detallada de nuestros pacientes para el diagnóstico y
tratamiento oportuno. Así pues, el objetivo de este artículo es
revisar la fisiopatología, clínica, tratamiento del GP y
proporcionarles nuestras recomendaciones según lo estudiado.
Historia
En 1899 Krukemberg
describió el depósito de pigmento en el endotelio corneal de
forma vertical y central, al que hoy llamamos huso de Krukemberg;
posteriormente, en 1901 Von Hippel postula que este pigmento
podría obstruir la salida del humor acuoso. En 1925 Mauksch
describe dos hermanos con glaucoma y dispersión de pigmento en
la cámara anterior y posterior del ojo; sin embargo, se
considera como glaucoma crónico de ángulo abierto, ya que en ese
momento gonioscópicamente la presencia del pigmento no fue
significativo. No es hasta 1949 que Sugar y Barbour introducen
por primera vez el término del GP al presentar dos pacientes con
dispersión pigmentaria y presión intraocular elevada. En 1979
Campbell presentó la teoría sobre el mecanismo del GP,
incluyendo la concavidad posterior del iris y su contacto con la
zónula.5
Epidemiología
Esta patología
compromete del 1 al 1,5% de todos los glaucoma en el mundo
occidental. Se ha estimado una incidencia de SDP de 4,8 por cada
100.000 habitantes, con incidencia de GP de 1,4.1,
5
Se han
identificado los siguientes factores de riesgo: miopía, edad,
raza y género. Se sabe que es más frecuente en caucásicos,
hombres entre 20 y 40 años de edad. Encontrándose que en altos
grados de miopía se han asociado al desarrollo de glaucoma
pigmentario. El SDP no tiene predilección de género específico a
diferencia del GP, que es más frecuente en hombres. Las mujeres
con GP tienden a presentar dicho cuadro una década después de
los hombres.1,
5
Recientes estudios
sugieren un posible patrón de herencia autosómico dominante;
Andersen y Wiggs informan cuatro familias con SDP cuya
alteración estaba presente a nivel del cromosoma 7q 35-q36.68
Hemos hablado de
cuan importante es el diagnóstico oportuno de
esta patología, por lo que es primordial conocer cuál es
la tasa de conversión de SDP a GP. Al respecto se ha
discutido mucho y los datos reportados son variables, desde 35%
en 17 años en un estudio, a 50% en 4 años en otro.
Esta
variabilidad podría deberse a que dichos estudios fueron
realizados por especialistas en glaucoma en cuyos centros de
investigación los pacientes estudiados fueron remitidos.
Recientemente Siddiqui y colaboradores determinaron que el
riesgo de conversión era del 10% en 5 años incrementándose a 15%
en 5 años. El factor más predictivo para la
conversión fue la presión intraocular mayor o igual a 21 mm Hg
en el diagnóstico inicial de SDP.1
Fisiopatología
Se ha demostrado
que la concavidad posterior del iris es una característica de
esta patología, que conlleva a la liberación de pigmento por
roce de la cara posterior del iris cóncavo con los haces
posteriores de la zónulas durante los movimientos pupilares
fisiológicos, es así que hoy en día los estudios de
biomicroscopía ultrasónica (BUM) han dilucidado aspectos de la
fisiopatología del SDP. Este sistema es capaz de representar
secciones de la parte anterior del ojo en vivo y en tiempo real
con una resolución microscópica.
Pavlin y
colaboradores confirmaron la presencia de una concavidad en el
iris, contacto iridozonular e incremento iridolenticular en
pacientes jóvenes con GP y propusieron la acomodación como causa
del mecanismo del bloqueo pupilar reverso. Robert Adam y
colaboradores durante un periodo de 10 años investigaron a 92
pacientes confirmando que el incremento posterior de la
concavidad del iris ocurre con la acomodación y muestra una
fuerte correlación entre el grado de acomodación, concavidad
posterior y edad.9
La concavidad del
iris aumenta por acomodación, el parpadeo también juega un papel
importante en determinar la concavidad del iris y en la
distribución del humor acuoso en el segmento anterior y
posterior del ojo. Cada pestañeo hace muescas en la córnea de
manera transitoria produciendo un ligero incremento en la PIO y
empujando al iris hacia atrás contra el cristalino. Una pequeña
cantidad del humor acuoso es así forzado de la cámara posterior
hacia la anterior, inmediatamente tras el parpadeo la presión de
la cámara anterior excede a la de la posterior y el gradiente de
presión hace que el iris se vuelva cóncavo, y que sea empujado
hacia el cristalino lo que impide que el humor acuoso fluya de
nuevo hacia atrás creando lo que se llama el “bloqueo pupilar
inverso”.4-6,
9, 10
A nivel
histopatológico se ha encontrado numerosos pigmentos en las
células trabeculares, pérdida de las mismas, pérdida de los
espacios intertrabeculares, fusión de lamelas y aumento del
material extracelular en la parte interna del canal de Schlem.
La separación de conexiones tendinosas en dicho canal también
han sido observadas; se han asociado estos cambios con regiones
de separación patológica de la pared interna de la región
cribiforme. Gottanka y colaboradores encontraron tres
características en todos los ojos estudiados con presión
elevada: primero, la pérdida de células trabeculares de grado
moderado fue una característica común tal como ha sido notado
con otros autores como Richardson y Alvarado. Esta pérdida
celular fue asociada con
colapso y fusión de las lamelas. En esas regiones también se
encontró un incremento de material extracelular bajo la pared
interna del canal de Schlem, probablemente causado por
subperfusión.
El segundo cambio patológico
temprano que se ha visto es la desconexión de las fibrillas de
conexión de la pared interna del canal de Schlem que podría
disminuir el tono mediado por el músculo ciliar en la pared
interna cambiando su dinámica durante la acomodación. Esto
podría disminuir la expansión de la pared del canal y de tejido
yuxtacanalicular que ocurre durante la acomodación
incrementándose la resistencia a la salida del flujo. El por qué
de la desconexión de las fibrillas es desconocido pero puede
ocurrir por la actividad lítica de enzimas liberadas durante el
proceso.
El tercer hallazgo es la
obstrucción de la luz del canal de Schlem con células
estrelladas y la elongación de sus respectivos procesos. Esta
obstrucción disminuye el área de entrada al canal para el humor
acuoso aumentando la 5, 6, 11, resistencia para la salida del
mismo. 1, 12
Clínica
Para realizar un buen
diagnóstico es necesario realizar una buena evaluación bajo
biomicroscopía del paciente. Teniendo presente que el pigmento
proveniente del epitelio pigmentario del iris se deposita en las
estructuras del segmento anterior y posterior del ojo, los
hallazgos son:
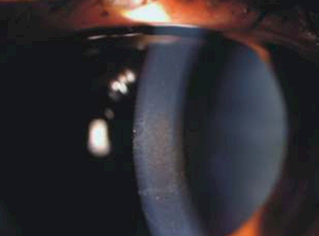
Córnea.
Se aprecia la acumulación del
pigmento vertical en el centro del endotelio corneal, conocido
como huso de Krukemberg (figura 1). El usual patrón de éste
depósito resulta de una unión lineal vertical de corrientes de
convección del acuoso de las mitades nasal y temporal de la
cámara anterior del ojo.13, 14 El pigmento acumulado en el
endotelio corneal es fagocitado. Se ha demostrado pleomorfismo y
polimegatismo endotelial bajo biomicroscopía especular. Federic
Lord y colaboradores, a diferencia de hallazgos en otros
estudios previos, no encontraron diferencias en la profundidad
de la cámara anterior, un hallazgo interesante fue que todos los
pacientes con SDP tenían queratometrías planas de
aproximadamente de 2 dioptrías en comparación a los controles.
La presencia de una córnea plana podría ser un factor inductor
del bloqueo pupilar reverso durante el parpadeo.7
Iris.
Los cambios en el iris incluyen depósitos de pigmento en la
superficie anterior y defectos en la periferia media expuestos a
la transiluminación del epitelio pigmentario del iris. Si el
depósito en la superficie anterior es asimétrico la heterocromía
puede ser notada. Los defectos de la transiluminación pueden
variar en severidad pudiendo ser vistos por retroiluminación
obtenida por iluminación directa a través de la pupila, el
examen idealmente debe realizarse en un cuarto oscuro. La
gonioscopía revela ligera concavidad en la periferia media del
iris con estroma delgado y quístico.5, 13,
14
|
 |
|
Figura 1.
Paciente 48 años con diagnóstico de glaucoma
pigmentario. Se observa depósito de pigmento endotelial,
llamado huso de Krukemberg. |
Pupila.
Las alteraciones en tamaño y
forma incluyen anisocoria, que se sabe a que hay hiperplasia del
músculo dilatador del iris. La pérdida del pigmento de la
superficie posterior del iris provoca una alteración en la
función pupilar conduciendo a un aumento del tamaño pupilar. En
la afectación asimétrica se encuentra en el ojo más afectado. La
combinación de un aumento del tamaño de la pupila y un iris más
oscuro en el ojo más afectado puede producir un síndrome de
pseudo Horner, donde el ojo menos afectado tiene una pupila más
pequeña y menos oscura.14-16
Cristalino y zónula.
El pigmento también puede
ser depositado en las zónulas y en la cápsula posterior,
particularmente en las zónulas posteriores. La pigmentación de
la cápsula posterior frecuentemente es llamada Línea de Scheie o
Zentmeyer.
Ángulo iridocorneal.
El pigmento negro y denso del iris posterior se deposita en la
trabécula, la cual se observa gonioscópicamente como una banda
densa homogénea en la circunferencia entera de la malla
trabecular a diferencia de la apariencia en parche en el SDP. El
SDP puede ocurrir en pacientes sometidos a ejercicios.14-16
Fundoscopia.
Jonas y colaboradores
encontraron que no había diferencias estadísticamente
significativas a nivel del nervio óptico o entre pacientes con
GP y glaucoma de ángulo abierto. 17
Tratamiento
Tratamiento médico.
El tratamiento del GP no difiere del tratamiento del glaucoma
pero se deben tener en cuenta ciertas consideraciones
especiales. Los agonistas colinérgicos como la pilocarpina
teóricamente suponen una ventaja para el tratamiento para el GP
porque la miosis que induce produce un estiramiento y
aplanamiento del iris separándolo de la zónula. Sin embargo los
pacientes miopes jóvenes no suelen tolerar los agonistas
colinérgicos por el espasmo de la acomodación, cefalea y miopía
que inducen, además debe tenerse cuidado de instaurar
tratamiento colinérgico porque existe un mayor riesgo de sufrir
2,
desprendimiento de retina.6, 14-16 Mastropasqua y Carpineto
compararon la eficacia de la aplicación de latanoprost versus
timolol en pacientes con GP durante 12 meses de tratamiento,
encontrando una reducción de la PIO más efectiva y bien tolerada
con el latanoprost.18.
Tratamiento con láser.
La iridotomía láser (IT) es
un tratamiento efectivo para restablecer una configuración
normal del iris. Con el fin de lograr ciertas ventajas clínicas,
el tratamiento deberá quedar no obstante reservado para aquellos
ojos que presenten un estado activo de liberación de pigmento o
una hipertensión ocular con o no una lesión glaucomatosa
temprana.4, 10, 12, 19, 20 Gandolfi
y colaboradores expusieron en 1996 tras dos años de seguimiento
un incremento de la PIO de 52,3% entre ojos no tratados frente a
un 4,7% de los tratados; este efecto tan positivo tuvo más
relevancia en los pacientes más jóvenes. Esto puede explicarse
por la reducción fisiológica de los contactos iridozonulares y
de la dispersión de los gránulos de pigmento con la edad, la
cual está relacionada con el aumento de la longitud axial del
cristalino con la edad.4, 19
Vale la pena mencionar la
importancia de realizar estudios prospectivos a largo plazo y en
una muestra considerable para establecer el beneficio sostenido
de la IT.12
Trabeculoplastia.
La trabeculoplastia argón láser
(ALT) puede ser muy efectiva en el GP, siendo necesario usar
energía baja del láser en estos pacientes para evitar el
incremento de la dispersión de pigmento. Se recomienda posterior
al láser la aplicación de agonistas alfa 2 adrenérgicos para
prevenir los picos de PIO extremadamente altos en GP. El efecto
de la ALT es mejor en pacientes jóvenes.6
Trabeculectomía.
Si el tratamiento médico y láser
fracasan puede realizarse una trabeculectomía debido a que los
pacientes tienden a ser jóvenes deben utilizarse antimetabolitos.
Recientemente se ha descrito una forma de cirugía de glaucoma no
filtrante, Jacobi y colaboradores proponen la aspiración
trabecular como una alternativa de tratamiento en pacientes con
SDP, ya que la respuesta a dicho tratamiento fue mejor en estos
pacientes que en los que presentaban GP.3
Conclusión
La finalidad de esta revisión es
dar a conocer esta patología, permitiendo un diagnóstico
temprano de la misma para un tratamiento oportuno. Si bien es
cierto la prevalencia de dicha enfermedad en nuestro medio es
más baja a lo reportado, vale la pena preguntarnos ¿cuántos
casos se dejan de diagnosticar, simplemente por no realizar una
evaluación pensando en que ese paciente podría tener GP como un
tipo de glaucoma secundario de ángulo abierto?
Así mismo, se prefiere la
remisión del paciente con GP con el glaucomatólogo.
Referencias
1. Siddiqui Y, Jhonson DH.
What is the risk of developing
pigmentary gaucoma from pgment dispersion syndrome.
Am J Ophthalmol 2007; 135:794-9.
2. García F. La iridotomía periférica con Yag
láser en el síndrome de dispersión pigmentaria / glaucoma
pigmentario. Rev Cuban Oftalmol 2002 ;15:49-56.
3. Jacobi PC. Effect of
trabecular aspiration on intraocular pressure in pigment
dispersion syndrome and pigmentary glaucoma. Ophthalmology 2000;
107:417- 21.
4. Carass R. Iridotomía laser
en glaucoma pigmentario. En: https://
www.glaucoma. Consultado: Marzo 8 de 2007.
5. Campbell L. Pigmentary
glaucoma. In: Rich R, Schields B. The glaucoma. Missouri: Mosby,
2 ed, 1996:975 89.
6. Yang JW, Krupin T.
Pigmentary glaucoma. J Glaucoma 2001; 10:S30- S32.
7. Lord FD. Keratometry and
axial length in pigment dispersion syndrome: A descriptive
casecontrol study. J Glaucoma 2001; 10:383-5.
8. Andersen JS, Pralea AM. A
gene responsible for the pigment dispersion syndrome maps to
chromosome 7q35-q36. Arch Ophthalmol 1997; 97:1667-72.
9. Adman R, Pavlin C.
Ultrasound biomicroscopic analysis of iris profile changes with
accommodation in pigmentary glaucoma and relationship to age. Am
J Ophthalmol. 2004; 138:4-8.
10. Méndez C, García J.
Estudio de glaucoma pigmentario mediante biomicroscopía
ultrasónica. Arch Soc Esp Oftalmol 2003; 78:137-42.
11. Gottanke J, Jonson DH.
Histologic findings in pigment dispersion syndrome and
pigmentary glaucoma. J Glaucoma 2006; 15:142-51.
12. Chet E, Schields B. The
influence of peripheral iridotomy on the intraocular pressure
course in patients with pigmentary glaucoma.
J Glaucoma 2005; 14;255-9.
13. Skuta L. Exfoliation syndrome, pigment
dispersión syndrome,
and the associated glaucomas. Duane Clinical Ophthalmology. CD
Rom. Baltimore: Lippincott Williams & Wilkins, 2006.
14. Liebman JM. Pigmentary
glaucoma. Basic and clinical science course.
CD Rom. Academia Americana de Oftalmología, 2003.
15. Arruda P. Glaucoma. México: Ciba vision,
1999.
16.Wallace LM.
Glaucoma. Madrid: Mosby, 2001.
17. Jonas J, Lang J. Optic
disc morphology in pigmentary glaucoma. Br J Ophthalmol 1998;
82;875-9.
18. Mastropasquea L, Carpineto
P. A 12 month, randomized, double-masked study comparing
latanoprost with timolol in pigmentary glaucoma. Ophthalmology
1999; 106:550-5.
19. Gandolfi SA, Vecchi M.
Effect of a Yag laser Iridotomy on intraocular pressure in
pigment dispersion syndrome. Ophthalmology 1996; 103:1693-5.
20. Chen MJ, Lin SC. Effect of
a Yag laser iridotomy on intraocular pressure in pigmentary
glaucoma. Br J Ophthalmol 2002; 86:14434.
* Fellow de Glaucoma,
Fundación Oftalmológica de Santander Clínica Carlos Ardila Lülle,
Bucaramanga, Colombia.
** Residente de Oftalmología,
Universidad Industrial de Santander, Clínica Carlos Ardila Lülle,
Bucaramanga, Colombia.
§ Fundación Oftalmológica de Santander Clínica
Carlos Ardila Lülle, Bucaramanga, Colombia.
¶ Centro de Prevención y Consultoría en Glaucoma,
Bucaramanga, Colombia.
Correspondencia: Dr.
Parra, Fundación Oftalmológica de Santander Clínica Carlos
Ardila Lülle, Urbanización El Bosque, Bucaramanga, Colombia.
E-mail: [email protected]
Artículo recibido: 27 de marzo de 2007; aceptado:
6 de julio de 2007
Autor: