|
|
|
Autor: |
|
Dr. Víctor Patricio Rivera Escalante |
|
|
|
Coautores: |
|
Dr. Víctor Molina Echeverría |
|
Dra. Juana Eulalia Coka Echeverría |

Fisiología de la Cicatrización
La respuesta de los tejidos vivos a la lesión constituye la base y el
fundamento de la práctica quirúrgica. En realidad, desde un punto de vista biológico, la lesión tisular y sus secuelas participan en la mayor parte de los problemas médicos generales.
La cicatrización de las heridas constituye una respuesta básica de los seres vivientes hacia la vida y, en general, produce restablecimiento satisfactorio de la integridad de los tejidos, algunos médicos dan por un hecho o ignoran la biología
de la reparación.
| Publicidad |
|

|
Historia
Las características biológicas de la reparación tiene raíces históricas. Los primeros escritos médicos conocidos se ocupan ampliamente del cuidado de las heridas. Siete de los 48 informes de casos incluidos en el Papiro Smith ( 1770 a. C. ) describen heridas y su atención. En forma empírica, los antiguos médicos de
Egipto, Grecia, India y Europa crearon métodos adecuados para tratar heridas y advirtieron la necesidad de extraer cuerpos extraños, suturar, cubrir las heridas con material limpio y protegerlas de la acción de agentes corrosivos.
Durante el siglo XIV, con el empleo extenso de la pólvora y la frecuencia cada vez mayor de heridas por bala, surgió una nueva época del tratamiento de las heridas. En vez de adoptar una actitud
pasiva en el atención de las heridas y depender de los procesos naturales de reparación, los cirujanos asumieron una postura más dinámica y emprendieron actos impresionantes para facilitar la "curación de las heridas". En vez del lavado suave con agua tibia y hervida y la aplicación de ungüentos emolientes, se comenzó a aplicar aceite en ebullición, cauterios al rojo y agua hirviente. Se olvidó la limpieza, y produjo resultados desastrosos.
A
mediados del siglo XVI Ambroise Paré , el gran cirujano militar francés, redescubrió los métodos atraumáticos. Como ocurre en muchas contribuciones científicas y en biología, la casualidad intervino. Durante la batalla de Villaine se agotó el abasto de aceite, y Paré no tuvo más remedio que aplicar tratamientos suaves a heridas por amputación. Para su sorpresa, las heridas cicatrizan rápidamente sin las complicaciones previstas. Desde ese comienzo, evolucionó la
época actual de la asistencia atraumática. John Hunter, William Stewart Halsred, Alexis Carrel y otros grandes clínicos biólogos demostraron que minimizar la lesión tisular permitía la cicatrización rápida y eficaz. La mayor parte de los progresos técnicos en el cuidado de la herida realizados en el siglo pasado se basaron en el concepto de la interferencia mínima; es decir, si el cirujano podía eliminar todos los impedimentos, los procesos de cicatrización
normales culminaría en el mejor resultado posible.
En la mayor parte de las situaciones clínicas este concepto sencillo y elegante tenía bases sólidas.
Sin embargo, por desgracia la reacción normal de los tejidos a la lesión no siempre culmina en un resultado perfectamente funcional. Los mismos procesos que generan potencia e integridad en las incisiones de la pared abdominal o del
intestino produce estenosis fibrosas del esófago, enfermedad valvular reumática, cirrosis hepática, encarcelamiento de tendones, queloides, adherencias intestinales y otras anormalidades. Si existieran métodos eficaces para controlar forma, tamaño y propiedades físicas de las cicatrices, surgiría una nueva época en el tratamiento de las heridas. Ya no se consideran inevitables los fenómenos fisiopatológicos producto de la formación de cicatrices .
El
proceso de cicatrización de las heridas puede modificarse experimentalmente con ventaja por eliminación o reducción de las consecuencias fisiopatológicas de la formación de cicatriz.
El término (cicatriz ) tiene interés en si mismo. Originalmente existía una palabra griega (eschara), que significaba hogar. El hogar estaba situado en el centro de la casa y alrededor de él tenía lugar toda la vida doméstica. Debido a tales
actividades, y a causa de la reunión de niños traviesos y esclavos alrededor del fuego, las quemaduras que producían cicatrices eran tan frecuentes que el nombre de la causa vino a ser sinónimo del efecto.
Gracias al tráfico comercial la palabra emigró a Roma, y se transformó en (cicatriz), de allí pasó a Francia en forma de la palabra (eschare), que significa en la actualidad el encostramiento que recubre una ulceración.
En las islas británicas, la palabram (eschare), se encontró con la palabra sajona (scaur), muy semejante a ella tanto en sonido como en significado .
En la Edad Media la palabra (cicatrix) tuvo una significación muy amplia, llegando a significar cualquier tipo de mancha blanca en la piel. Escleroderma, morfea, vitiligo se incluían en esta denominación. Incluso las manchas blancas (leuconiquia ) visibles a menudo en las uñas.
Herida
Es
el área donde queda interrumpida la continuidad anatómica celular entendiéndose por una solución de continuidad de las cubiertas externas del cuerpo, de revestimiento mucoso o de la superficie de los órganos.
Una lesión tisular es el común denominador de toda herida quirúrgica, afecta al organismo en diversas formas, incluyendo pérdida local de sangre y líquido, dolor con estímulos neurales eferentes hacia el cerebro y
órganos endocrinos y liberación de productos celulares hacia la circulación. Una herida inicia la catabolia y una herida abierta constantemente inhibe la anabolia
La mayor parte de heridas curan hasta lograr integridad tensil durante el periodo de balance nitrogenado negativo, entendiendo por integridad tensil a la recuperación de una superficie de resistencia tensil en el propio tejido de manera que puedan suprimirse los apoyos
artificiales. Esto puede significar la supresión de puntos de sutura en la piel, la función de anastomosis gastrointestinales y la curación de vasos sanguíneos o líneas de sutura visceral5 . El restablecimiento del metabolismo nitrogenado hacia el estado anabólico (síntesis de proteína) , tiene mayor importancia para recuperar la fuerza muscular y el vigor que para la curación de las heridas.
En todas las heridas
hay una alteración metabólica continua que dura semanas, meses o incluso años después que el proceso de curación ha logrado la integridad tensil recuperada .
Una herida abierta constantemente inhibe la anabolia proteínica y la reanudación del crecimiento del convaleciente , las quemaduras demuestran este fenómeno de manera muy clara cuando la herida cura con injertos o cerrándola, se produce un cambio muy neto que se
manifiesta clínicamente y se acompaña de un aumento en la rapidez para lograr una anabolia nitrogenada con proporciones relativamente bajas de calorías de nitrógeno por vía bucal o venoso36.
La transmisión del mensaje desde la herida al organismo sigue siendo manifiesta y poco conocida.
La repuesta postraumática neuroendocrina y metabólica para favorecer la curación de
la herida se inicia por estímulos nerviosos aferentes, por la pérdida de sangre e infección, todos colaboran para informar al resto del organismo de la existencia de una herida o de una incisión con lo que inician los cambios fisiológicos adecuados.
La piel es un órgano sensitivo que recoge información a través de una extensa red de neuronas y terminales nerviosas. Aportan información sobre presión, vibración, dolor y
temperatura. Los peligros externos se detectan y pueden emprenderse acciones para evitarlos y minimizar la lesión. La lesión se asocia con la liberación de mediadores químicos que estimulan las terminaciones nerviosas del dolor de las fibras A (delta) y C que entran en la médula espinal a través de la raíz posterior.
El riesgo de lesión aumenta cuando se pierde la sensibilidad. La pérdida de sensibilidad puede ser el
resultado de la sección aguda de un nervio sensitivo periférico, de una lesión nerviosa crónica, o por debajo del nivel de sección transversal de la médula.
Puede producirse entonces una lesión más grande del área ya que no se puede transmitir información sobre la proximidad de un peligro.
La neuropatía diabética representa una disminución de la sensibilidad de las
extremidades inferiores. Las fibras nerviosas de conducción rápida (A, alfa, transmisoras de la propiocepción y las A, delta, del dolor) son las que se afectan por la lesión vascular, perdiéndose en primer lugar la sensibilidad vibratoria.
El paciente no recibe ningún aviso de la lesión o de la infección de una herida menor. Dado que la diabetes también provoca anomalías en el proceso de curación y en el aporte vascular,
estas heridas pueden acabar en una úlcera permanente. La lepra causa una destrucción gradual de los nervios por invasión bacteriana y la correspondiente respuesta inmunológica. Las extremidades insensibles están sometidas a lesiones, que pueden inducir grandes deformidades. Fotos 1A - 1B.
|

|
|
Foto #1A.- Ulceración Post Desvitalizada.
|
|
|
|

|
|
Foto #1B.- Cicatrización Post Desarticulación.
|
Componentes de cada Capa de la Piel
La piel consiste en dos capas principales, la epidermis externa y la dermis subyacente. Las estructuras epidérmicas especializadas como los folículos pilosos y la glándulas sebáceas y sudoríparas se sitúan en la dermis sin interrumpir la unión dermoepidérmica. Bajo la dermis se encuentra el tejido hipodérmico de sostén, o tejido graso
subcutáneo. Contiene nervios y sus terminales, vasos sanguíneos que irrigan la piel y linfáticos.
|

|
|
Fig. #1 Sección de la piel mostrando: A piel normal; B: herida superficial; C:herida de profundidad parcial; D: herida de profundidad total.
|
La epidermis tiene cinco estratos celulares. Las células de la capa basal se reproducen constantemente. Las células más viejas son desplazadas hacia la superficie, donde se depositan. Un proceso de transformación gradual cambia las células redondas y nucleadas de la capa basal en las escamas planas y ricas en queratina, que se encuentran en las capas externas de la epidermis. Estas células están muertas.
La
dermis consiste en un tejido hecho de fibras de colágeno y elastina en una matriz de mucopolisacáridos, irrigadas por una trama vascular muy rica. La dermis sostiene la epidermis. La elastina de la dermis le aporta elasticidad y la colágena su fuerza de tensión. El grosor de la dermis y por tanto, su tensión, varían según cada parte del cuerpo, lo que se comprueba al comparar como ejemplo las características de la piel de la espalda con las de la piel del párpado.
La
unión de la dermis y la epidermis forma una serie de ondas llamadas pedículos radiculares o papilas. Los apéndices de la epidermis, como los folículos y las glándulas sudoríparas, están revestidos de células epiteliales y se introducen en la dermis sin interrumpir la unión dermoepidérmica.
Profundidad de la Herida
Las heridas de la piel se pueden
clasificar según las capas afectadas. Las heridas superficiales afectan sólo la epidermis.
Las de profundidad parcial afectan la dermis. Las heridas de profundidad total llegan hasta el tejido subcutáneo o incluso a mayor profundidad.
La dermis estará intacta si, al examinar una herida, se puede identificar las marcas normales de la piel como las huellas dactilares. Una lesión que
afecte parcialmente el grosor de la piel mostrará una dermis rosada y uniformemente pálida. La lesión dérmica más profunda mostrará islotes de grasa amarillenta que penetrarán en la trama dérmica. En heridas de profundidad total, se verán áreas continuas de glóbulos de grasa sin dermis subyacente. El sangrado de una herida superficial se produce a partir de múltiples bocas puntiformes.
En las heridas dérmicas más
profundas, se ven puntos de sangrado de mayor tamaño y más separados. Las heridas de profundidad total y penetrantes pueden mostrar un sangrado arterial pulsátil o un sangrado continuo de origen venoso.
|

|
|
Fig. # 2 Migración de las células epiteliales a través de la superficie de la herida durante la regeneración .
|
Reparación
La reparación de la epidermis lesionada se produce por regeneración, un proceso similar a la producción normal de la epidermis. Las células de la capa basal se multiplican, migran hacia atrás desde las áreas no lesionadas y substituyen las áreas lesionadas. La reparación consiguiente tiene una estructura y aspecto normal y no deja cicatriz
visible. La reparación de la dermis se produce por un proceso denominado granulación. La proporción de constituyentes y la arquitectura de la reparación difieren de la dermis normal. La curación de la lesión superficial de la dermis produce la formación de una señal permanente de la reparación , la cicatriz. La tensión que soporta una herida afecta la manera como se depositará el colágeno cuando esté en proceso de curación, la tensión de la cicatriz
consiguiente y su aspecto.
|

|
|
Fig. # 3
|
Las lesiones de profundidad parcial de la piel pueden dejar células viables de la epidermis en la base de los pedículos radiculares o en la parte dérmica de los apéndices, que formarán islotes de células epidérmicas en un mar de dermis. La reparación de la epidermis se realiza a través de la migración y multiplicación de las células de estos islotes, hasta que formen una capa continua que curará la herida. (Foto 2). La
infección de una herida superficial destruirá los elementos epidérmicos residuales, reduciendo la capacidad de la herida para reepitelizarse.
|

|
|
Foto. # 2 Islotes de epitelio regenerante, extendiéndose para cubrir la herida.
|
Etapas Parciales de la Cicatrización
 |
Cuadro No. 1 |
Si los folículos pilosos, las glándulas sudoríparas y las sebáceas de un área determinada se destruyen por una lesión o una infección, no se podrán regenerar. El tejido cicatricial resultante tenderá a romperse y fisurarse, ya que carecerá del lubricante sebáceo normal. Puede también suceder que no haya pelo. Esto es particularmente importante en área como el cráneo, en el que una zona sin pelo puede constituir un problema
cosmético. La piel de la cabeza se afecta muchas veces en los niños cuando sufren un escaldamiento. Incluso en heridas superficiales, se puede producir una pérdida de pelo si después la herida se infecta.

Formas de Cicatrización
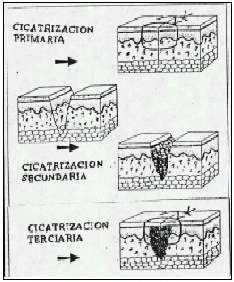
Los cirujanos dividen por costumbres los tipos de cicatrización en primera, segunda y tercera intención.
Cicatrización
por Primera Intención
Llamada también unión primaria ocurre cuando el tejido es incidido (un corte aséptico) y es suturado con precisión y limpieza, la reparación ocurre sin complicaciones y requiere de la formación de solo una pequeña cantidad de tejido nuevo. En este tipo de cicatrización el cierre por aproximación de cada una de los planos es lo ideal.
|
|
|
Fig. #4
|
Cicatrización por Segunda Intención
Cuando la herida deja de sanar por unión primaria ocurre un proceso más complicado y prolongado y que es la cicatrización por segunda intención causado por lo general por infección, trauma excesivo con perdida de tejido o aproximación imprecisa de los tejidos (espacio muerto cerrado).
|

|
|
Fig. #5
|
En este caso la herida puede ser dejada abierta y permitir la cicatrización desde los planos más inferiores hacia la superficie.
El tejido de granulación contiene miofibroblastos que cierran la herida por contracción, el proceso de cicatrización es lenta y el cirujano puede requerir tratar el exceso de granulación que se destaca en los márgenes de la herida, retardando la epitelización,
la mayor parte de las heridas y quemaduras infectadas cicatrizan en esta forma.
Cicatrización por Tercera Intención
También llamada como cierre primario retardado y esto ocurre cuando dos superficies de tejido de granulación están juntas. Esto es un método seguro para reparar las heridas contaminadas, asi también las sucias y las heridas traumáticas
infectadas con grave pérdida de tejido y alto riesgo de infección, este método es usado ampliamente en el campo militar asi como trauma relacionado a accidente de automotores, de arma de fuego o heridas profundas penetrantes de cuchillo.
El cirujano generalmente trata las lesiones debridando los tejidos no viables y dejando la herida abierta, la cual gana gradualmente suficiente resistencia a la infección lo cual permite un
cierre no complicado, este proceso esta caracterizado por el desarrollo de capilares y tejidos de granulación, cuando se emprende el cierre, los bordes de la piel y el tejido subyacente debe ser cuidadosamente y en forma eficaz aproximado, como si fuera por primera intención.
Es menos probable que se infecte la herida mientras está abierta, que la herida que ha sido cerrada en forma primaria. La herida cerrada tiene máxima
susceptibilidad a la infección durante los primeros 4 días. La herida por injertos cutáneos es también un ejemplo de cicatrización por tercera intención.
Causas de Cicatrización Patológica
Factores Mecánicos.
Cruce de líneas de tensión.
Cicatrización
defectuosa (Incremento de la tensión en la herida) falta de inmovilización del área de la lesión.
Factores Locales.
Localización región escapular, esternón linfostasis, inflamación prolongada (quemadura).
Factores raciales e individuales
Razas
mediterráneas
Negros
Pelirrojos
Trastornos metabólicos
Diabetes
Latirismo
Deficiencia vitamínica: Vitamina C,K
Deficiencia
proteínica
Deficiencia en oligoelementos: Zn, Cu, Co, Fe
Aterosclerosis
Enfermedades Neurológicas
Tabes dorsalis
Siringomieliaj
Para y tetraplejía
Acción
física
Rayos ultravioleta, Rayos X , infecciones
Enfermedades infecciosas, sífilis, tuberculosis
Infecciones de heridas; abscesos, Flemones gangrena.
Enfermedades hematológicas y otros.
Cirrosis hepática, fibrosis
Retroperitoneal
Fibrosis pulmonar insterticial
Epilepsia postraumatica, lepra
Enfermedad válvular reumática, contractura Dupuytren
Medicamentos
Cortisona, antiflogísticos, hormonas
Formas
patológicas de formación de cicatrices
Cicatriz hipertrófica
Cicatriz atrófica
Queloide
Cicatriz inestable
Cicatriz pigmentada
Cicatriz retardada
Carcinoma de
cicatrización
Clasificación de las Heridas
Presentamos las definiciones empleadas en el estudio de 1964 por el consejo nacional de Investigación, en el cual desempeñaron papel directivo la Universidad de Cincinnati y el Dr. Altemeier. Una herida se califico de infectada si producía pus.
Una herida que
presentaba signos de inflamación o exudado seroso se calificó de "posiblemente infectada" . Estas heridas se vigilaron diariamente hasta que se resolvieron (no infectadas) o supuraron (infectadas).
Todas las heridas se incluyeron en una de las cuatro categorías siguientes, basándose en la estimación clínica de la contaminación de la herida observada por la enfermera en la sala de operaciones.
Herida
Limpia.- No se observó infección, No hubo errores en la técnica aséptica. No se abrió ningún órgano muscular hueco. Sin embargo, se incluyeron tres operaciones -colecistectomía, apendicectomia e histerectomía- en esta categoría si no hubo inflamación alguna.
Herida Limpia Contaminada.- Se abrió un órgano muscular hueco, pero tuvo lugar un escape mínimo de contenido.
Herida
Contaminada.- Se abrió un órgano muscular hueco, escape profuso de su contenido; o se descubrió inflamación aguda sin formación de pus.
Se incluía en este grupo una herida traumática de fecha menor de cuatro horas, igual que operaciones llevadas a cabo con un error importante en la técnica de asepsia.
Herida Sucia.- Al operar se encuentra pus, o una víscera perforada.
En esta categoría se incluye cualquier herida traumática producida por más de cuatro horas3.
La meta del cirujano es mantener el cierre primario de la herida ante un paciente que va a ser sometido a una cirugía ya sea electiva o de emergencia y que los bordes de la herida que fueron escindido permanezcan en aposición o próximos por medios mecánicos hasta que se produzca la cicatrización y no necesite de estos
soportes para recuperar la fuerza tensil, muchos factores tienen un impacto en el papel del cirujano ante un procedimiento y a la elección de materiales de cierre.
Esto analizaremos a continuación.
Factores que afectan la decisión quirúrgica de la sutura de heridas.
Factores Locales y Generales
Cicatrización
secundaria y hormonas de las heridas. Buen número de biólogos con gran imaginación han sugerido en el transcurso de los años que los tejidos lesionados producen hormonas específicas de herida, sustancias que según se afirma circulan libremente en la sangre e incrementan la velocidad de la cicatrización .
Hasta la fecha ningún dato experimental decisivo apoya esta hipótesis. En la mayor parte de casos, las diferencias
observadas en los ritmos de cicatrización dependen de otros factores.
Sin embargo, estos experimentos propiciaron una observación importante sobre el comportamiento de las heridas abiertas suturadas de nuevo.
A principios de la década de 1940, Botsford observó que las heridas incisas que se dejaron cicatrizar sin impedimento alguno durante breves periodos y que después se abrieron
para suturarlas de nuevo inmediatamente adquirieron resistencia a una velocidad muy superior a la de las heridas primarias. Los experimentos de Dunphy14 y colaboradores, y de otros establecieron que este fenómeno de cicatrización secundaria de la herida estaba enteramente relacionado con los factores locales.
El contenido de colágena de las heridas secundarias extirpadas es al parecer el mismo o incluso menor que el de
las heridas primarias de la misma edad.
Sin embargo, las características relacionadas con el tiempo del metabolismo de la colágena cicatrizal parecen explicar la cicatrización secundaria. Como ya se dijo, las heridas primarias requieren varios días a fin de prepararse para la síntesis de colágena, y continúa sintetizándola y depositándola a ritmo acelerado durante periodos prolongados. La abertura y la nueva sutura de las
heridas al parecer no ejerce efecto sobre el ritmo de depósito de nueva colágena33.
De este modo, en las heridas abiertas y nuevamente suturadas, así como en las heridas primarias, la adquisición de nueva resistencia depende al parecer menos del contenido de colágeno que de la velocidad de depósito de nueva colágena.
Factores Relativos a la
Nutrición General.
Las heridas incisas en animales alimentados con dietas exentas de proteínas durante periodos prolongados adquieren resistencia lentamente. Aunque el plasma restablece la cinética normal de la herida, la concentración de proteínas plasmáticas no se correlaciona con las anomalías locales de la herida. La administración de DL- metionina o cistina tan sólo impide el retraso de la cicatrización. Este
efecto no parece relacionado con síntesis de colágena, y es aún oscuro el mecanismo de los efectos de la depleción de proteínas sobre la cicatrización de las heridas. Aunque es motivo de preocupación frecuente, se desconoce todavía la magnitud del efecto de la depleción de proteínas sobre la cicatrización de las heridas en el hombre 27-28. Se ha pensado que también la senectud influye adversamente en la cicatrización. Los datos no sugieren que los
mecanismos de este fenómeno sean más eficaces en el joven; las complicaciones de la cicatrización en el anciano al parecer dependen más bien de problemas pulmonares y cardiovasculares que de factores inherentes de la herida19.
Deficiencias de Vitaminas y Oligoelementos
Estudios experimentales indican que la síntesis de colágena puede
progresar a ritmo bajo en animales con deficiencia de ácido ascórbico. Sin embargo, cuando las circunstancias requieren síntesis rápida, la depleción de este ácido ejerce efectos profundos sobre la producción de colágena. La administración de cantidades relativamente pequeñas de vitaminas C restablece la cicatrización normal, y no es necesaria la saturación . Aunque nos hemos referido a la función del ácido ascórbico en la síntesis de colágena, las anomalías
fisiológicas en el escorbuto no se limitan al metabolismo de la colágena. El ácido ascórbico, potente agente reductor, está implicado al parecer en otros diversos sistemas de oxidorreducción. La cicatrización normal de las heridas requiere cantidades adecuadas de ácido ascórbico, pero los estados de deficiencia son raros en el mundo occidental salvo en alcohólicos o en individuos gravemente desnutridos. La vitamina A y su deficiencia han sido implicados en los
fenómenos anormales de la cicatrización de las heridas. Aunque todavía no se ha profundizado plenamente en las consecuencias de la definición de vitamina A, se sospecha que dicha vitamina es un antagonista específico de ciertas anormalidades creadas por la cortisona y sus derivados 13-16.
En la actualidad se estudia intensamente la participación de los metales en la cicatrización de las heridas. Como se conoce, son
necesarios cobre y oxido ferroso para el metabolismo normal de la colágena, si bien rara vez se observan- quizá nunca - estados de deficiencia. El cinc y otros cationes divalentes actúan como cofactores en muchas reacciones metabólicas, y los estados de deficiencia en animales retardan la epitelización y el aumento de la resistencia. Se ha sugerido la deficiencia relativa de cinc como causa de epitelización deficiente en niños con grandes quemaduras. Sin embargo, los
datos al respecto son todavía equívocos 8.
Anemia, Perdida de Sangre y Tensión de Oxígeno
Muchos clínicos creen firmemente que la anemia de cierto grado retrasa la cicatrización, así mismo ha quedado establecida la importancia de la tensión de oxígeno en la cicatrización.
Sabemos hoy que la
caída prolongada de dicho parámetro dificulta notablemente la cicatrización. 43 Los datos sugieren que las concentraciones relativas de las isoenzimas de deshidrogenasa láctica ( LDH ) varían con la PO2 del tejido de la herida, y que pueden ser importantes en la regulación de la síntesis de colágena.
Para la cicatrización normal es al parecer más importante el riego tisular adecuado que la capacidad de aporte de
oxígeno de la sangre. La hemorragia o la anemia solas quizá no alteren la tensión de oxígeno en los tejidos; sin embargo la hipovolemia, la vasoconstricción y el aumento de la viscosidad de la sangre pueden producir efectos profundos sobre la tensión local del oxígeno. La temperatura ambiente influye también en dicha tensión en la piel y afecta la cicatrización de las heridas, Por otra parte, las heridas adquieren nuevas resistencias más rápidamente a temperaturas
ambientales elevadas. El riego sanguíneo local es al parecer decisivo, ya que el decremento de la vasoconstricción local por desnervación de la piel anula el efecto de la temperatura sobre la cicatrización.
La cuanción ocurre más rápidamente en la cara y en el cuello porque recibe el más grande suministro de sangre pero es más lenta a nivel de las extremidades. Así la presencia de cualquier conducción que comprometa el
suministro de sangre a la herida, así como una pobre circulación a los miembros, como en el paciente diabético, llevaría a retrasar la cicatrización.
 |
Cuadro No.2 |
Fumar reduce la tensión de oxígeno de la sangre y del tejido subcutáneo de las heridas. El nivel de hipoxia producido por fumar se asocia con una curación defectuosa. La hipoxia dura unos meses después de la interrupción del hábito de fumar. Se cree que esto es debido a la vasoconstricción inducida por la nicotina. Los fumadores tienen más riesgos de necrosis de los colgajos cutáneos y de presentar úlceras periféricas .43
Estrés,
Esteroides y Agentes Antinflamatorios
La cortisona y sus derivados reducen la velocidad de síntesis de proteínas, estabilizan las membranas lisosómicas e inhiben la reacción inflamatoria normal. En casi todas las especies estudiadas, incluyendo el hombre, las dosis altas de corticoides limitan la gemación capilar, inhiben la proliferación de fibroblastos y reducen el ritmo de epitelización. La administración experimental
de esteroides antes de provocar una herida o inmediatamente después produce el efecto máximo. 16
En general, incluso con dosis altas de esteroides las reacciones de cicatrización de las heridas llegan a término; tan sólo se modifica la escala del tiempo. Todas las fases de la cicatrización progresan mucho más lentamente, y la mayoría de los clínicos coinciden en que en los pacientes que reciben terapéutica
prolongada a base de esteroides y que deben someterse a intervenciones quirúrgicas es mucho mayor el riesgo de cicatrización demorada. Sin embargo, si se realizan ajustes cuidadosos en cuanto a la alteración de la escala del tiempo, puede minimizarse las complicaciones de la herida.
Los otros antinflamatorios usados con frecuencia (derivados salicílicos, fenilbutazona) ejercen efectos mínimos sobre la cicatrización. Es sabido
que las dosis masivas experimentales de aspirina retrasan notablemente la ganancia de resistencia, pero las dosis farmacológicas no producen efecto alguno. 25
Algunos pacientes presentan alergias al material de sutura utilizado, al metal o prótesis. Lo que eleva su respuesta inmune en forma de rechazo a los tejidos.
Respuesta Inmune de los Pacientes
Citotóxicos y Radiación
Los cambios crónicos inducidos en los tejidos por la energía radiante de onda corta producen efectos profundos sobre la cicatrización , los efectos de la radiación aguda y los de otros agentes citotóxicos influyen también en el ritmo de cicatrización. La mayor parte de los agentes citotóxicos producen sus mayores efectos sobre las células en división. Es lógico deducir de nuestra exposición
previa que cualquier agente que inhiba la división de las células epiteliales o de los fibroblastos locales debe impedir o retrasar la cicatrización. Por fortuna, la administración sintética de mostaza nitrogenada. TioTEPA, 5- fluorouracilo y otros antimetabolitos rara vez producen concentraciones titulares suficientemente altas para influir en la división de las células en las heridas. Sin embargo, la aplicación local prolongada de estos agentes (sobre todo
5-fluorouracilo) puede impedir por completo la cicatrización. En forma análoga, las dosis altas de radiación, especialmente durante los tres primeros días , retrasan notablemente la ganancia de resistencia .
La Edad Del Paciente: Con el envejecimiento la piel y el tejido muscular pierde su tono y elasticidad, el metabolismo también se retarda y se daña la circulación, todos estos factores alargan la cicatrización .
El
Peso Del Paciente: En los pacientes obesos de cualquier edad, debido al exceso de grasa a nivel de la herida se dificulta un buen cierre por planos y en adición, la grasa no tiene buen suministro de sangre, lo que hace más vulnerable a estos tejidos ante un trauma o una infección .
Deshidratacion.- Si existe una depleción de los fluidos en el cuerpo humano, los resultados del desbalance en la función del riñon, el
metabolismo celular , la oxigenación de la sangre y la función hormonal no solo impactan en las condiciones generales del paciente y su recuperación quirúrgica, sino también que retrasan el proceso de cicatrización .
Respuesta Biológica Tisular
La cicatrización de las heridas representan una serie integrada altamente dinámica de acontecimientos
celulares, fisiológicos y bioquímicos que ocurren exclusivamente en organismos completos. Aunque los componentes individuales de la reacción cicatrizal (multiplicación y emigración celular, síntesis y entrecruzamiento de colágena, etc.) se presentan en cultivos de tejidos o incluso en sistemas exentos de células, las heridas no cicatrizan en un frasco , ni se producen acontecimientos de ningún género en casos de aislamiento .
Si
bien todas las heridas cicatrizan por los mismos procesos básicos, las heridas clínicas son de dos tipos: cerradas simples y abiertas, con pérdidas de tejidos o sin ella.
Heridas Cerradas. Respuesta Tisular a la Injuria.
Inflamación. La destrucción de la integridad de los tejidos inicia una serie de cambios morfológicos en verdad sorprendentes.
Después de una vasoconstricción transitoria se dilatan todos los pequeños vasos locales, y a medida que ocurre esta dilatación, el endotelio se torna anormalmente permeable para las proteínas y el plasma, los cuales llegan así al sitio de la lesión. Coincidiendo con los cambios vasomotores, los leucocitos comienzan a adherirse a las superficies endoteliales, especialmente de las pequeñas vénulas, y se desplazan activamente a través de las paredes vasculares. Pocas
horas después de la lesión, el espacio de la herida se llena de un exudado inflamatorio muy rico en células compuesto de leucocitos eritrocitos, proteínas plasmásticas solubles y bandas de fibrina. La duración e intensidad de esta respuesta inflamatoria depende de la cantidad de tejido local lesionado. Desde luego que la lesión extensa de los tejidos o la presencia de cuerpos extraños o bacterias puede prolongar la fase inflamatoria durante meses. Sin embargo, en el
caso usual de incisión limpia, la inflamación aguda mejora bastante en término de pocos días.
En las primeras etapas de la inflamación, leucocitos muy móviles emigran a la herida y comienzan a engullir y eliminar restos celulares y fragmentos de tejido lesionado. En primer lugar predominan al parecer los leucocitos polimorfonucleares. Al finalizar la fase transitoria de emigración leucocítica (diapédesis) y morir y sufrir
lisis los granulocitos de vida breve y liberar éstos hidrolasas ácidas en el medio local, aumenta significativamente la proporción de monocitos, y los índices de supervivencia diferencial explican las modificaciones de la población celular. Los monocitos persisten en su actividad fagocítica durante semanas.
Estudios con antisueros anticelulares específicos sugieren que la cicatrización progresa normalmente en ausencia de
linfocitos y de granulocitos polimorfonucleares. En contraste, debe haber monocitos para la producción de fibroblastos normales e invasión del espacio de la herida. 26
Epitelización. Mientras se eliminan los materiales muertos de las regiones más profundas, ocurren acontecimientos muy importantes en los bordes de las heridas epiteliales. En efecto, las heridas cutáneas, la epidermis inmediatamente vecina al
borde de la herida comienza a engrosarse 24 horas después de la lesión. Las células básales marginales pierden su firme adherencia a la dermis subyacente, aumentan de volumen y entonces comienzan a emigrar cruzando el defecto. Las células básales fijas en una zona cercana al borde seccionado experimentan una serie de divisiones mitóticas rápidas y las células hija emigran, presumiblemente dirigidas mediante guía por contacto a lo largo de las bandas de fibrina y por
inhibición de contacto 38. En término de 48 horas la superficie de la herida en su totalidad está cubierta de nuevo de epitelio.
En este momento, las anfractuosidades más profundas de la herida contienen tan sólo bandas de fibrina y células inflamatorias. Después de formarse puentes a nivel del defecto, las células epiteliales emigrantes pierden su aspecto aplanado, adoptan una forma más cilíndrica e incrementan
su actividad mitótica. Se establece así la formación de capas de epitelio con queratinización de las células de la superficie. Sin embargo, la interfase epitelial mesenquimatosa no recupera nunca su arquitectura norma.
La notable respuesta de las células epiteliales a la lesión no queda restringida a las áreas superficiales .Por ejemplo, si persisten durante varios días suturas en heridas cutáneas, las células epiteliales
emigran hacia ellas, y la queratinización y el engrosamiento epitelial subsiguiente pueden producir reacciones manifiestas de cuerpo extraño y formación de abscesos estériles. Incluso las suturas subcuticulares que seccionan folículos pilosos o glándulas sudoríparas pueden quedar rodeadas de bandas de epitelio y producir quistes epiteliales 39 .
Fase Celular. A medida que mejora la reacción inflamatoria y
que aumenta el espesor de la superficie epitelial, aparece un nuevo tipo de células en la profundidad de la herida. A partir del segundo o tercer día, una serie de células fusiformes con núcleos ovales aumentan notablemente en número, y al cabo de 10 días dominan la población celular, poco después de esta invasión de células aparecen fibras de colágena en la herida. Datos concluyentes indican que este nuevo tipo de célula, el fibroblasto, sintetiza y secreta
moléculas de colágena. Aunque en términos generales el fibroblasto activo se describe como una célula fusiformes o estrellada, observaciones directas de material vivo revelas que los fibroblastos pueden adoptar casi cualquier configuración .
Datos recientes indican que casi todos los fibroblastos vivos en las heridas en trance de cicatrización derivan de células mesenquimatosas locales, especialmente de las asociadas con la
adventicia del vaso sanguíneo
Si las células circulantes son capaces de convertirse en fibroblastos fijos, como sugieren algunos autores, desempeñan sin duda un cometido insignificante en la cicatrización de las heridas.
En el momento en que los fibroblastos locales comienzan a moverse en la herida, el espacio de ésta se llena de bandas de fibrina. Aunque al parecer los fibroblastos
migratorios utilizan la red de fibrina como andamiaje, no sabemos todavía si las bandas de fibrina proporcionan orientación o guía por contacto. Sin embargo, a diferencia de las células amiboides, las células epiteliales y los fibroblastos requieren un sustrato sólido o semisólido para sus movimientos de deslización. Los fibroblastos y células epiteliales se desplazan por formación de contacto adhesivos con el sustrato, no por flujo citoplásmico.
Los
fibroblastos no poseen enzimas fibrinolíticas. Grandes cantidades de fibrina, coágulos sanguíneos o tejidos muertos forman una barrera física que impide la penetración del fibroblasto y retrasa la producción de fibras de colágena. Por fortuna, el fibroblasto cuenta con una ayuda.
En efecto, la proliferación rápida de los capilares constituye un rasgo prominente de toda cicatrización temprana de una herida. En las heridas
abiertas o cerradas se forman nuevos capilares por gemación de las vénulas existentes.
Las células endoteliales proximales a la lesión experimentan mitosis rápida y las distales pierden sus fijaciones a la membrana basal y se movilizan en el interior del área lesionada. A diferencia de los fibroblastos, el endotelio se desplaza como una lámina contigua .Como las células endoteliales proliferan a partir de muchos puntos,
pronto se establece una rica red de pequeños vasos. Las células endoteliales poseen un activador muy poderoso de plasminógeno. Así a medida que los fibroblastos avanzan en el área lesionada, seguidos de cerca por los capilares en proliferación, ocurre fibrinólisis que destruye la red de fibrina.
Fibroplasia . La fase celular fija de la cicatrización de la herida dura varias semanas. Sin embargo, hacia la cuarta o
quinta semana disminuye notablemente el número absoluto de fibriblastos en la herida . Además, la rica red capilar queda reducida a unos pocos sistemas de capilares bien definidos . Durante toda la vida de la cicatriz, un pequeño número de células permanece asociado con el material cicatrizal, pero estos fibrocitos no poseen el retículo endoplásmatico activo característico de los fibroblastos.
A medida que disminuye la
población de fibroblastos, las fibras de colágena se convierten en el rasgo anatómico dominante de las herida. Las primeras fibras de colágena aparecen cuatro o cinco días después de la lesión, y rápidamente el espacio de la herida se llena de pequeños haces de fibras orientados al azar los cuales aumentan gradualmente de volumen y producen una estructura densa y masiva de colágena (la cicatriz) que une firmemente los bordes de los tejidos seccionados. Todas las
cicatrices, profundas y superficiales, cambian de volumen y forman de manera lenta y progresiva con el curso de los años. En algunas personas poco afortunadas las cicatrices se agrandan y producen queloides masivos o cicatrices hipertróficas. En otras, la zona palidece, disminuye su volumen, reaparece la pigmentación normal y termina por desaparecer la cicatriz. El tejido cicratizal en casi todas las incisiones abdominales permanece firme y resistente, aunque a veces las
cicatrices de abdomen se desplazan, se amplían y pierden resistencia, y de este modo ocurre hernias incisionales.
El fenómeno del remodelado de la cicatriz es básico para el funcionamiento de los tejidos lesionados El aspecto macroscópico de las cicatrices en trance de remodelado sugiere que con el tiempo y por un mecanismo desconocido las fibras de colágena se han modificado y entrelazado formando diferentes patrones
arquitectónicos.
Inflamación. Desde los comienzos de este siglo, en varios estudios experimentales se demostró concluyentemente que las sustancias locales liberadas por la lesión producen vasodilatación y una mayor permeabilidad de vasos finos. En un principio se consideró a la histamina el mediador primario de la respuesta inflamatoria vascular. Como es sabido la histamina, liberada por granulocitos, células cebadas y
plaquetas, produce vasodilatación local y permeabilidad de los pequeños vasos. Aunque existe en los exudados inflamatorios tempranos, la histamina actúa durante breves períodos (menos de 30 minutos) debido a que sus fuentes locales se agotan rápidamente. En el hombre los efectos locales de la serotonina son insignificantes. Debido a lo breve de su acción, no parece probable que dependan de estas aminas las reacciones inflamatorias prolongadas.
Recientemente
se ha implicado a las cininas, una serie de péptidos biológicamente activos, y a las prostaglandinas, principalmente PGE 1, y PGE 2, en las respuestas vasculares inflamatorias locales. La calicreína, enzima encontrada en el plasma y en los granulocitos, libera bradicinina y kalidina a partir de la O alfa globulina del plasma. En presencia de cininas y el sistema de complementos, las células locales producen diversas prostaglandinas, que actúan probablemente regulando los
niveles del nucleótico cíclico de la célula. Las prostaglandinas al parecer son los mediadores finales de la inflamación aguda, incluyendo la permeabilidad reversible de vasos finos, y posiblemente tengan una función quimiotáctica en fibroblastos y leucocitos. Aspirina e indometacina son potentes inhibidores de la biosíntesis de prostaglandina, y la acción antiinflamatoria de estos fármacos puede deberse a sus efectos sobre el matabolismo de la protaglandina.
La
segunda fase de la respuesta inflamatoria, esto es la invasión local por los leucocitos puede tener también mediadores químicos. Se llegó a creer que la leucotaxina, para algunos un péptido formado en los tejidos lesionados por la destrucción enzimática de la albúmina, era un agente quimiotáctico, que atraía los leucocitos hacia las áreas lesionadas. No han tenido actividad quimiotáctica en las concentraciones encontradas en los tejidos lesionados . Los extractos
de leucocitos e incluso ciertas formas de colágena producen quimiotaxis leucocitaria en situasiones experimentales, si bien no se ha dilucidado su papel en la cicatrización de las heridas.
Sustancia Fundamental
Las cicatrices maduras y en desarrollo poseen los mismos componentes extracelulares básicos de todo tejido mesenquimatoso, es decir, proteínas
fibrosas principalmente (colágena) y glucosaminoglicanos (mucopolisacáridos, mucoproteínas y glucoproteína). Todos los tejidos conectivos contienen cantidades variables de glucosaminoglicanos, que son macromoléculas gigantescas compuestas principalmente de carbohibratos y de una cantidad variable de proteínas, los primeros estudios histoquímicos y determinaciones de hexosamina sugirieron que durante los tres o cuatro primeros días de la cicatrización, las heridas
sintetizan grandes cantidades de glucosaminoglicanos. Durante los días siguientes, a medida que aparece la colágena en la herida, el contenido de hexosamina disminuye drásticamente. Los investigadores concluyen que la producción y depósito de mucopolisacáridos prepara y dirige a los fibroblastos para producir colágena. Por desgracia los valores de hexosamina por sí solos no reflejan con exactitud el contenido de glucosaminoglicanos de la herida. El análisis detallado
de los tipos de compuestos ricos en hexosamina brinda pruebas concluyentes de que el aumento temprano refleja la aparición de glucoproteínas séricas transportadas a la herida por el exudado inflamatorio inicial, por lo que no se trata de compuestos sintetizados localmente 14.
Por lo general el contenido de ácido hialurónico del tejido de la herida permanece relativamente constante o dismiuye durante las tres primeras
semanas de la cicatrización. Por el contrario, la concentración de condroitina-4- sulfato y de dermatán sulfato aumenta progresivamente desde el cuarto hasta el vigésimo primer día. La aparición de las fibras de colágena no produce caída brusca en la concentración . Hasta la fecha, no se ha establecido un papel claramente definido de los glucosa-minoglicanos en la cicatización de las heridas.
|

|
|
Fig. #6 Relación entre los niveles de los constituyentes de las heridas con el tiempo y las fases de la curación.
|
Características Químicas y Metabolismo de la Colágena.
La molécula de colágena, llamada a veces tropocolágena, es un filamento rígido de 3000 Å de longitud y 15 Å de ancho . Esta unidad funcional no es un polipéptido simple, sino que cada molécula está compuesta de tres cadenas de polipéptidos enroscadas entre sí, con una relación helicoidal
características. Cada cadena tiene un residuo de glicina cada tres posiciones en el esqueleto peptídico. Por último, todas las colágenas contienen dos ácidos singulares, hidroxiprolina e hidroxilisina La elastina contiene mínimas cantidades de hidroxiprolina y también el componente CLq del complemento y la porción final de la acetilcolinesterasa, pero para todos los fines prácticos este aminoácido es exclusivo de la colágena y comprende, en promedio, 10% de la
molécula. La prolina, que es el otro aminoácido, comprende otro 10 % de casi todas las colágenas. De este modo, la midad de la molécula está compuesta sólo por tres ácidos que son glicina, hidroxiprolina y prolina.
La colágena constituye la principal proteína estructural de todos los vertebrados , y se sabe que su cantidad excede del 30 % del contenido total de proteínas en casi todos los animales. Existe diferencias
específica en las colágenas de las distintas especies y de los distintos tejidos dentro del mismo animal, pero en todos los tipos prevalece la configuración molecular rígida "cilíndrica".
En el periodo en que los fibroblastos se dividen y penetran en el espacio de la herida se sintetiza poca colágena. Sólo después de que se ha formado un número importante de fibroblastos (entre el segundo y tercer día, por regla)
comienza a ser fácilmente medible la síntesis de colágena. Los datos sugieren que la hipoxia a consecuencia del daño de la microcirculación y la inflamación desencadena un gradiente del lactato, que puede ser la señal que transforme colágena. Si las células requeridas para sintetizar colágena son privadas rápidamente de ácido ascórbico, se observa el mismo fenómeno.El mecanismo de la hidroxilación de la lisina es semejante, y tiene las mismas necesidades
de sustrato y de cofactor.
Una segunda reacción metabólica específica en la síntesis de la colágena posee interés especial para el cirujano. Durante la formación de enlaces cruzados de la colágena destacan ciertas reacciones del aldehido. Los tejidos mesenquimatosos poseen una enzima, la lisilo aminooxidasa (LAO), que produce desaminación oxidativa de los grupos e amino de lisina. Los aldehidos resultantes producen enlaces
covalentes intermoleculares. La lisilo aminooxidasa requiere iones cobre como cofactores, y en consecuencia la depleción o la quelación del cobre impide la formación de aldehidos y la consiguiente formación de enlaces cruzados.
Además, cierto tipo de compuestos llamados latirógenos inhiben en forma específica la formación de enlaces covalentes por inhibición de la actividad de la lisilo aminooxidasa o por quelación de los
aldehidos resultantes.
Como la orientación y los enlaces cruzados de las fibras de colágena determinan las propiedades mecánicas de las cicatrices, los factores que influyen en la arquitectura de dichas fibras determinan la fisiología de la cicatriz. Sin embargo, la arquitectura de la fibra en los diferentes tejidos mesenquimatosos y en las cicatrices no corresponde a la disposición al azar vista en los tubos de ensayo.
Los
grandes haces de colágena de los tendones se hallan orientados en series paralelas con sus ejes longitudinales también paralelos a las líneas de tensión. Aunque el tejido cicatrizal entre los extremos reparados del tendón se halla al principio orientado al azar, al transcurrir el tiempo los haces de colágena se alinean con los fascículos tendinosos normales.
Otra vía indirecta por medio de la cual las células quizá
influyan en el tamaño y orintación de la fibra es a través de su producción de glucosaminoglicanos.
Por último, el descubrir de una forma precursora de colágena y de una proteasa específica asociada con la conversión a moléculas nativas sugiere que la formación de fibra puede ser controlada por factores físicos y bioquímicos. Hasta la fecha se desconoce la importancia biológica de procolágena y procolágena peptidasa,
si bien este aspecto del metabolismo de la colágena está siendo investigado intensivamente. Si el sistema procolágena- procolágena peptidasa es un factor importante para el control del tamaño y la agregación de fibra, los cirujanos pueden controlar farmacológicamente este aspecto de la formación cicatrizal.
Resistencia de las Heridas
Las heridas
adquieren con el tiempo más fuerza. El restablecimiento de la integridad tisular y la resistencia debido a las reacciones normales de cicatrización permite al cirujano realizar las manipulaciones inherentes a la terapéutica moderna. El ritmo de fortalecimiento y la recistencia final de las heridas determinan qué material de sutura debe utilizarse , cuándo procede quitar los puntos, cuándo debe reanudar sus actividades el paciente, y por qué ciertas incisiones pueden
ser más apropiadas que otras.
Casi toda la información sobre relaciones de resistencias de las heridas en trance de cicatrización procede de experimentos en animales.
Todas las propiedades mecánicas medibles de los objetos físicos dependen de la dirección e intencidad de anplicación de la fuerza. Aunque se han utilizado muchos parametros mecánicos .
Los
dos empleados con más frecuencia son resistencia a reventar y resistencia a la tensión .Estas mediciones no son intercambiables. La resistencia a la tensión mide la carga necesaria por área de sección transversal para provocar rotura; la resistencia a reventar mide la carga requerida para abrir o romper una herida de cualquier dimensión.
El aumento de resistencia de las heridas incisas comienza inmediatamente después de la
sutura. En dos días, la resistencia a la rotura en heridas incisas de la piel de la rata llega a 50 ó 100 g por cm lineal. La cavidad de la herida contiene tan sólo bandas de fibrina, algunas asas capilares, leucocitos y unos cuantos fibroblastos. Sin embargo, la superficie epitelial consta de una hoja o lámina confluente de células.
|
 |
|
Fig. #7 La gráfica mustra la relación entre la fuerza de tensión y el tiempo transcurrido desde la herida.
|
Con la aparición de las fibras de colágenas hacia el tercer día, aumenta rápidamente la resistencia. Hacia los 21 días, la resistencia a la rotura llega hasta 1 kg por cm lineal. A pesar de conceptos erróneos generalmente sostenidos, el incremento de la resistencia no se detiene aquí .Llegados a ese punto, incluso estudios cuidadosamente ejecutados no han podido revelar una meseta en lo que se refiere a resistencia. Por el
contrario, las heridas de la piel continúan ganando resistencia a un ritmo relativamente rápido y constante durante más de cuatro meses y a velocidad algo menor durante un año.
La adquisición prolongada de nueva resistencia no se limita a las heridas de la piel, ya que las de músculos y aponeurosis adquieren resistencia lentamente, y el ritmo de incremento en caso de lesiones tendinosas es todavía más lento 28-34.
A pesar de la ganancia prolongada de resistencia, las heridas rara vez -quizá nunca- recuperan la resistencia de los tejidos normales.
Además, la resistencia no es el único parámetro físico importante de la cicatriz. En la cicatriz se pierde la elasticidad normal, tan necesaria para el funcionamiento de los tejidos. Los productos de la cicatrización de la herida, aunque resistentes, a menudo convierten un tejido elástico y
flexible en una masa inelástica y quebradiza.
Las propiedades físicas de las cicatrices depende de las fibras de colágena que contienen. Aunque otros componentes de las cicatrices maduras (células, epitelio, vasos sanguíneos y moléculas de sustancia fundamental) contribuyen a dar resistencia a la herida, la magnitud de la contribución de la colágena es inmensamente superior; la mejor prueba al respecto puede obtenerse de dos
fuentes.
En el escorbuto se producen pequeñas cantidades de colágena en los tejidos normales. Sin embargo, si los tejidos sufren una lesión, el ritmo de síntesis de colágena es ya inadecuado para producir cicatriz. Procede recordar que el ácido ascórbico es el donador normal de electrones necesario para la reactividad de peptidilprolina hidroxilasa (ppH) .En el escorbuto existe entonces una deficiencia en la síntesis de
coláena cicatrizal .En las heridas de animales con escorbuto se produce epitelización normal y la cavidad de la herida se llena da fibroblastos, capilares y grandes concentraciones de glucosaminoglicanos. Se observan todos los productos normales de la cicatrización de la herida salvo colágena, y sin embargo, la adquisición de nueva resistencia por la herida es mínima.
La segunda prueba en apoyo de la importancia primaria de la
colágena en la adquisición de nueva resistencia procede de estudios sobre los agentes latirógenos en la cicatrización de las heridas. El beta aminopropionitrilo (BAPN), que es el osteolatirógeno más potente entre los conocidos, inhibe específicamente la producción de aldehidos derivados de lisina durante la síntesis de colágena. Cuando se administra beta aminopropionitrilo a animales con heridas, las moléculas de colágena son sistetizadas y excretadas a un ritmo
normal. La colágena extracelular se aglomera normalmente pero no se forman a tiempo los enlaces covalentes intermoleculares e intramoleculares, aunque las fibras de colágena latirógenas se antojan normales durante su estudio al microscopio electrónico, su resistencia física está notablemente disminuida. Los mejores datos al respecto indican que el beta aminopropionitrilo no ejerce efecto sobre la síntesis o el funcionamiento de ningún otro componente del tejido
conectivo. Así, no solamente son necesarias fibras colágenas, sino también reacciones de formación de enlaces covalentes intermoloculares normales para la adquisición de nuevas resistencias en las heridas durante la cicatrización.
Las cicatrices podrían adquirir resistencia cuando menos de tres maneras: con el tiempo podría aumentar la densidad de las fibras por adición de más y más colágena a la herida; las fibras
existentes podrían obtener mayor fuerza con el tiempo por aumento de la densidad del enlace covalente intermolecular por incremento de su fusión con componentes no colágenos, o podría cambiar con el tiempo la disposición arquitectónica de las fibras de colágena, produciendo una nueva y más fuerte configuración.
Mediante experimentos en los que se han empleado compuestos marcados con radioisótopos se demuestra que durante
las tres primeras semanas de cicatrización se acumula rápidamente colágena en la cicatriz en heridas de la piel de la rata. Sin embargo, después de las tres semanas no se observa acumulación adicional32. Si se compara la acumulación neta de colágena cicatrizal con la ganancia en la resistencia, se observa una correlación positiva durante las tres primeras semanas, pero no después. En las heridas del músculo, la acumulación de colágena cicatrizal puede
estar relacionada con la ganancia de resistencia durante las seis primeras semanas 1 .Los cambios en cuanto a la resistencia de la herida no dependen del total de colágena cicatrizal presente.
|

|
|
Fig. #8
|
Resistencia de las heridas de la piel de la rata comparada con la acumulación neta de colágena cicatrizal. Nótese que durante las tres primeras semanas existe correlación entre resistencia y contenido de colágena. Sin embargo, después de tres semanas, la herida continúa ganando resistencia rápida pero cesa la aculmula ción de colágena cicatrizal. Una vez transcurridas tres semanas no se observa correlación entre el contenido de
colágena y la resistencia.
Resulta interesante el hecho de que aunque la resistencia de las heridas cutáneas no guarda correlación con el contenido total de colágena, la adquisición de nuevas resistencias sí se correlaciona con los parámetros dinámicos del metabolismo de la cicatriz (ritmo de depósito de una nueva colágena y del recambio ) durante tres meses por lo menos.
La
resistencia a la rotura o resistencia final de las cicatricas depende de las propiedades físicas de las fibras de colágena. Aunque otros muchos componentes tisulares (incluyendo glucosaminoglicanos) pueden influir en la determinación del tamaño y orientación de las fibras y en el aporte de sostén interfibrilar, poseen importancia primordial al respecto el entrelazamiento y el enlace cruzado característico de las fibras de colágena. Las heridas incisas ganan
resistencia lentamente durante periodos prolongados. Aunque al principio existe correlación con el contenido de colágena, finalmente la resistencia de la cicatriz depende al parecer más de las características de los enlaces intermoleculares de las fibras individuales y del entrelazamiento de dichas fibras. Por último, los cambios arquitectónicos en las fibras de colágena cicatrizal parecen guardar relación con el recambio rápido y prolongado de la colágena de la
cicatriz.
Maduración de la Cicatriz
La resistencia de la cicatriz aumenta progresivamente con el tiempo después de la herida, pero el incremento de dicha resistencia es sólo una faceta del comportamiento de la cicatriz. El aspecto de una cicatriz cambia de manera impresionante con los meses, proceso que a veces recibe el nombre de maduración. Por lo
regular implica una pérdida gradual
del color rojo y de la dureza que es característica de las primeras etapas de la cicatrización de la piel, hasta que la cicatriz se vuelve blanquecina, blanda y no adherida a estructuras subyacentes. El aspecto a menudo se aparta notablemente del cuadro camún. Las cicatrices pueden ser angostas o anchas, elevadas o deprimidas, finas o gruesas, y resistentes. Desde el punto de vista
histológico y bioquímico, a pesar de su aspecto los análisis de las cicatrices brindan resultados muy similares. Uno de los planteamientos fundamentales en la biología de la cicatrización es la forma en que el mismo "bloque básico" que es la colágena puede estructurarse morfológicamente en forma tan diversas.
|

|
|
Fig. #9
|
Relación del ritmo de síntesis de colágena con la resistencia a la tensión de las heridas de la piel de rata. Nótese que el ritmo neto de síntesis y depósito de colágena persiste elevado durante todo el periodo de estudio. A pesar de un contenido estable de colágena, en las heridas incisas continúa sintetizándose y depositándose colágena rapidamente durante intervalos prolongados. diferencia del contenido neto de colágena
cicatrizal, el ritmo neto de depósito de nueva colágena se correlaciona con la ganancia de resistencia durante todo el intervalo de estudio
Todas las cicatrices cambian lenta y progresivamente de forma y tamaño.
Durante las fases tempranas de la cicatrización de las heridas, su cavidad se llena por completo de fibras orientadas al azar. Todos los tejidos lesionados, con entera
independencia de las suturas cuidadosamente aplicadas por el cirujano, quedan finsionadas en una unidad por fuertes fibras de colágena. En efecto, los tejidos lesionados forman una sola herida. Como el abdomen puede funcionar normalmente en presencia de una cicatriz que une peritoneo, músculo, aponeurosis, tejido subcutáneo y piel en una sola unidad, quedan siempre satisfechos cirujano y paciente. Por desgracia, semejante resultado no es satisfactorio en otras muchas
situaciones. Porejemplo, si una herida de la mano afecta piel, aponeurusis palmar, músculo lumbrical, tendón, periostio y huesos, todos los tejidos lesionados quedan unidos rápidamente en una cicatriz, y si bien se restablece la integridad y la potencia de la mano, es ya imposible todo movimiento activo del dedo. Para lograr funcionamiento es preciso unir los extremos seccionados del tendón junto con el fuerte tejido cicatrizal, pero debe modificarse el carácter de la
vinculación de la cicatriz y el tendón con las estructuras inmóviles circundantes para permitir el deslizamiento. Durante las últimas fases de la curación de las heridas, las cicatrices cambian su disposición anatómica. En el caso de un tendón flexor desgarrado , las fibras colágenas dispuestas en red y distribuidas al , azar se orientan con el tiempo en forma muuchos másespecífica 38. Las fibras colágena cicatrizal entre los extremos del tendón se
orientan en haces paralelos semejantes a los deltendón normal. Este entrecruzamiento físico establece una fuerte unión entre los extremos tendinosos capaz de transmitir fuerzas longitudinales muy grandes.
Así, en el transcurso de muchos meses, el tejido colágeno orientado inicialmente al azar se reorganiza de nuevo para formar estructuras que recuerdan el estado anterior de la lesión (haces paralelos de colágena entre los
extremos del tendón, estructuras parecidas a vainas peritendinosas en torno a las superficies de deslizamiento).
El tejido cicatrizal humano contiene grandes cantidades de colagenasa, que se encuentra en heridas muy recientes de 14 días o bien antiguas de 31 años. Otra prueba indirecta de la existencia de un estado de equilibrio de la colágena cicatrizal en las heridas humanas procede de observaciones clínicas en el escorbuto.
Las descripciones clásicas de esta enfermedad aluden a heridas cerradas durante años que se abren "La deficiencia de ácido ascórbico inhibe la síntesis rápida de la colágena, pero no influye en su destrucción. Un equilibrio dinámico prolongado entre la síntesis y la destrucción de la colágena cicatrizal podría explicar este fenómeno 11. así como otras reacciones anormales en la cicatrización de las heridas. Por ejemplo, alteraciones breves de
este equilibrio podrán producir las cantidades anormalmente elevadasde colágena observadas en queloides retroperitoneal, además de las cantidades anormales pequeñas características del escorbuto.
Además del recambio prolongado, existen mecanismos todavía mal conocidos que controlan el remodelado de la cicatriz.
Observaciones clinicas en el hombre sugieren que ciertas fuerzas
físicas desempeñan un importante cometido. En efecto, las líneas cruzadas de incisión de dimensiones variables producen grandes cicatrices hipertróficas; las incisiones entre los pliegues cutáneos normales, donde la tensión es mínima, pruducen heridas pequeñas que cicatrizan fácilmente. Sin embargo, la tracción moderadas sobre heridas en trance de cicatrización al parecer incrementa el ritmo de adquisición de nuevas resistencias. Recientemente se ha demostrado en
forma experimental la influencia de la tensión sobre la remodelación del tejido cicatrizal4. Sin embargo, desconocemos todavía cómo influyen magnitud, intensidad, dirección, frecuencia y duración de la aplicación del estímulo nocivo sobre el tamaño final y las propiedades físicas del tejido cicatrizal. Durante el remodelado de los huesos, campos eléctricos locales producidos por la deformación de los cristales óseos influyen en la orientación de la matriz del
hueso. Sin embargo, no se ha comprobado la influencia de los campos locales en la cicatrización del tejido blando normal.
Heridas Abiertas
Las heridas abiertas con pérdida de tejido o sin ella plantean problemas clínicos totalmente distintos de los correspondientes a las heridas incisas y suturadas. Aunque los procesos químicos y morfológicos básicos
que actúan en las heridas cerradas participan en la cicatrización de las heridas abiertas, surge ahora la contracción como una carácterística importante y la epitelización desempeña un papel más destacado, si bien procede señalar que los dos procesos son al parecer independientes44.
Las heridas incisas que permanecen abiertas inician normalmente el proceso de cicatrización; es decir se acumula exudado
inflamatorio en la superficie, las células epiteliales marginales se movilizan, dividen y emigran hacia los bordes; las vénulas lesionadas forman por gemación capilares, y los fibroblastos invaden la zona lesionada.
Los primeros observadores, impresionados por la índole finalmente granulados de la nueva superficie, denominaron a este material tejido de granulación y que puede ser estimulado su producción usando derivados de
caña de azúcar5 (Foto #3).
 |
Foto #3.- Tejido de Granulación |
Al cabo de tres o cuatro días, la superficie de la herida puede cerrarse por suturas u otros dispositivos mecánicos, progresando normalmente la cicatrización. Investigaciones bacteriológicas cuidadosas han revelado que en las heridas con contaminación masiva que permanecen abiertas pueden observarse reducción manifiesta de la concentración de bacterias durante los tres a seis primeros días En muchos casos, la demora en la
oclusión de las heridas contaminadas puede evitar la infección clínica. Esta técnica, iniciada durante la Segunda Guerra Mundial, ha adquirido después enorme popularidad.
Cuando no se retrasa la oclusión o en presencia de pérdida de tejidos, ocurre con el tiempo un cambio notable en las dimensiones físicas de la herida. Unos dos o tres días después los bordes se aproximan entre sí, reduciendo el tamaño del defecto de la
superficie. Desde hace siglos se reconoció la notable tendencia de las heridas abiertas a su reducción. Sin embargo, no fue sino hasta hace poco cuando se investigaron los mecanismos implicados en esta reducción o contracción de las heridas.
Observaciones clínicas en el hombre y animales han revelado que la reducción de las heridas cutáneas depende del estiramiento de la piel circundante cercana al defecto, y no de la
producción de nueva piel. En regiones donde la piel es relativamente laxa y no existen estructuras móviles cercanas, la reducción o contracción de la herida produce deformación mínima. Por ejemplo, un defecto de 10 x 10 cm encima de la región glútea que contrae en una extensión de 2 x 2 cm produce menoscabo funcional mínimo. En contraste, cuando posee importancia la movilidad de la piel, la contracción de la herida produce graves anomalías funcionales. Así ,
vemos que un defecto de 4 x 4 cm en el dorso de la mano que se contrae 2 x 2 cm puede producir deformidad de los dedos en extensión permanente. Dado que al parecer la contración es restringida por la tensión desarrollada en la piel en torno al defecto, la simple tracción de los bordes de la herida junto con la piel reproduce la deformidad final. Así la contracción de un defecto en el párpado superior puede producir ectropión , la del espacio antecubital una
contractura en flexión del codo, y la de la piel de la región axilar una contractura en aducción del brazo.Desde luego, la contracción de las heridas abiertas causan graves deformidades en el hombre, y el control de este proceso inexorable constituye parte importante de la labor del cirujano, como la piel está normalmente bajo tensión moderada, la extirpación de un fragmento de espesor completo produce un defecto ligeramente mayor que el de la muestra resecada.
Después de una demora de dos o tres días los bordes dérmicos comienzan a acercarse uno a otro.
Entre el quinto y el décimo días, los bordes de la herida se movilizan con rapidez, pero después y durante dos semanas la movilización es de nuevo lenta. En un defecto cuadrado o rectangular, los puntos medios de los lados se mueven más rápidamente que los ángulos, y la cicatriz final es estrellada.
Aunque
la superficie de granulación produce grandes cantidades de colágena, para la contracción normal de la herida no se requiere ni síntesis de colágena ni fuertes enlaces covalentes entre las fibras. Las heridas cutáneas en el hombre y animales con escorbuto producen pequeñas cantidades de colágena y, sin embargo, se contraen normalmente. Además, la inhibición del enlace covalente, con agentes latirógenos no ejerce efecto alguno sobre la contración. Las fibras de
colágena propiamente dicha no están compuestas de proteínas contráctiles. ¿Dónde se origina entonces la fuerza?
Desde luego, en todos los casos la fuerza para la contracción de la herida procede de células vivas. Los agentes citotóxicos en dosis no mortales, especialmente los venenos de citocromo, inhiben la contracción de la herida en forma manifiesta, y su efecto es reversible, cualquier tratamiento que inhiba la
motilidad celular produce efectos importantes sobre la contracción de la herida .Sin embargo, todaviá se debate dónde residen las células de las cuales depende la contracción de la herida. La iradiación del área local durante la fase de división activa del fibroblasto retarda notablemente la contracción.
Gabbiani y colaboradores han identificado un tipo epecifico de célula en el tejido de granulación que puede pepresentar
el elemento contátil del cual depende la contracción de la herida 17-18. En esta célula, muy singular, se combinan las caracteristicas ultraestructurales del fibroblasto y de la célula del muslo liso.
Una amplia variedad de datos apoyan el concepto de que células atípicas parecidas a las del músculo liso suministran la fuerza motriz para la contración de la herida.
El
ciclo vital de estas células en una herida abierta en granulación corresponde al periodo de contracción de la herida 41. Por último, cabe señalar que los agentes antimúsculo liso aplicados en forma tópica inhiben por completo la contracción de la herida 31.
Aunque todavía es objeto de controversia el mecanismo preciso de la contracción de la herida, los factores que inducen el inicio y la inhibición
del proceso contrátil poseen importancia primordial para el tratamiento. Las fuerzas de contracción propician el cierre de la herida hasta que son equilibradas por una tensión igual de la piel circundante. Aunque las tensiones ejercidas por el tejido cercano pueden disminuir con el tiempo, para todos los fines prácticos de herida se contrae hasta que los tejidos fijos impiden contracción adicional. Es de todos sabido que ciertas manipulaciones biológicas influyen en el
proceso de contracción. En oposición a la creencia popular, la epitelización por si misma no inhibe la contracción de la herida 45. Dicha contracción puede minimizarse sustituyendo de inmediato la piel que falta por injertos cutáneos o colgajos provistos de pedículo. El área final de defectos después de la aplicación del injerto depende de varios factores importantes. Los injertos cutáneos de espesor completo inhiben muy eficazmente el mecanismo de
contracción mientras que la inhibición con los injertos de espesor es mínima. Entre más grueso sea el injerto más extensa será el área final. Una vez iniciada la contracción, la restitución de la piel que falta es mucho menos eficaz para inhibir el proceso contrátil .Una conbinación de reposición inmediata de la piel más inmovilización mecánica por estructura ósea de la regiíon o mediante dispositivos externos constituye el método más eficaz para minimizar
la contracción de la herida 45.
En regiones de tejidos fijos con pocos exceso de piel (cuero cabelludo o tegumento de la parte inferior de la pierna ) la contracción máxima no puede cerrar un defecto más o menos importante, ya que no es posible la tracción de suficiente piel hacia la herida en estos casos la superficie de la herida queda al descubierto como una úlcera crónica, o cierra por epitelización. En los
defectos de espesor completo, la epitelización ocurre por mecanismos idénticos a los descritos al ocuparnos de las heridas cerradas. Sin embargo, la magnitud del proceso y sus consecuencias son enteramente distintas. Incluso en lesiones de espesor parcial, en las cuales las células de los apéndices dérmicos ayudan a la epitelización, los resultados distan de ser satisfactorios.
Las heridas abiertas quedan cubiertas por
proteínas plasmáticas desnaturalizadas o desecadas y células muertas esto es, por la costra en las lesiones térmicas, la colágena dérmica desnaturalizada puede persistir en su lugar y formar una escara. En ambos casos se produce epitelización debajo de la superficie de cubierta. En las lesiones térmicas con escara intacta, las células epiteliales emigrantes secretan colagenasa, la cual destruye las conexiones indemnes de colágena.. Debajo de la costra, las células
epiteliales emigran sobre el tejido colágena de la base de la herida
Aunque las capas epiteliales poseen notable capacidad migratoria, la extensión de sus migraciones no es infinita. En efecto, las células pueden emigrar 1,2 e incluso 3 cm desde el borde de la herida en circunstancias especiales, pero rara vez cubre defectos mayores. Si la zona es demasiado amplia para ser cubierta por epitelización y contracción, la herida se
convierte en una úlcera crónica.
Cuando transcurre demasiado tiempo ,en las heridas abiertas de este tipo puede producirse una forma sumamente maligna de carcinoma de células escamosas, si bien la protección adecuada puede evitar esta complicación desastrosa. Como hemos dicho en la piel normal, el tejido cicatrizal epitelizado constituye una capa epidérmica superficial con una base más profunda de colágena. En condiciones
normales, la epidermis está firmemente adherida a la dermis mediante una fuerte membrana basal ondulante. Los clavos interpapilares y los apéndices epidérmicos (folículos pilosos, glándulas sudoríparas, glándulas sebáceas ) proporcionan una fuerte conexión dermoepidérmica. Sin embargo la unión del epitelio con tejido cicatrizal es siempre débil , poco resistente, al grado de que fuerzas cortantes mínimas producen separación con pérdida del epitelio. El tejido
cicatrizal en el hombre carece de apéndice epidérmicos. La cicatriz epitelizada constituye en verdad un sustitutivo muy eficiente de la piel.
Células, Matriz, Factores de Crecimiento en la Cirugía.
Las heridas de la piel fetal cicatrizada son caracterizadas por ausencia de tejido cicatrizal en formación.
Este
único proceso de repatración no depende de la esterilización del medio ambiente intrauterino .Las diferencias entre las heridas de piel fetales y adultas parecen reflejar procesos intrínsicos del tejido fetal tales como los fibroblastos fetales únicos, una más rápida y ordenada sedimentación y volumen de los componentes titulares y particularmente de una marcada reducción del infiltrado inflamatorio y perfil de citoquina. Las heridas fetales cicatrizadas son
relativamente deficiente en citoquina inflamatorio ya que transforma el factor de crecimiento Beta (TGF-beta).
En constrate las fibrosis características de las heridas en el adulto pueden estar asociada a un exceso del factor de crecimiento beta. Estudios experimentales recientes sugieren que la estrategia terapéutica especifica con antil GFB pueden aminorar la formación de la cicatriz en la reparación de las heridas del adulto
y las fibrosis. Los inhibidores TGFB beta puede ser drogas importantes para el futuro en el control de la cicatriz 2.
Interleucina 6 en Heridas Activas
La interlucina 6 es una citoquina multifuncional con efectos locales y sistémicos durante las reacciones inmunológicas e inflamatoria. Las interleuquina 6 actúa en los fluidos de heridas es
liberada en células cultivadas y lesionadas con proliferación de los fibroblastos. Las interleuquina 6 está elevada a nivel de suero dentro de las primeras 12 horas después que la herida libera leucocitos polimorfo nucleares macrófagos y fibroblasto 35.
Los macrófagos de una herida recolectada 5 días después de la lesión produce más interleuquina 6 que aquello tomada al día 3 a 10, por una anti-interleuquina 6,
anticuerpo que parcialmente revierte la supresión de la proliferación fibroblástica en el fluido de la herida y en heridas con macrófagos cultivados. En las heridas recientes los leucocitos polimorfonucleares responsable de la aparición inmediata del proceso inflamatorio, parecen ser el origen en la circulación de la interleuquina 6 después de la lesión. En las heridas crónicas la interleuquina 6 puede proporcionar señales de supresión de la proliferación de los
fibroblastos 35.
Distintos poblaciones de keratinocitos básales producen Stromelysin 1 % Stromelysin 2 en úlceras crónicas, sugieren que estos dos metalproteinasas matrices juegan un rol distinto en la reparación de los tejidos 42.
Stromelysin 1 y Stromelysin 2 están fuertemente relacionado a distinta metal proteinasas y ambas pueden ser degradadas por muchas
macromoléculas de tejidos correctivo no colagenasa. Stromelysin 1m RNA. and protínas pueden ser detectadas en Keratinocitos, básales, adyacentes pero dístale a los bordes de la herida y que probablemente representan los sitios de proliferación epidérmica en contraste. Stromelysin 2 m RNA fue encontrado solo en keratinocitos básales a la migración frontal, en la misma población celular epidérmicas que exprese colágena.
Tratamiento
de las Heridas
En realidad, todas las consideraciones técnicas en cirugía pueden considerarse como métodos para la interferencia del cirujano en la cicatrización normal. Sin embargo, si nos basamos en nuestra descripción sobre el comportamiento biológico, son evidentes ciertos principios generales en el cuidado de todas las heridas. Los factores que retrasan la cicatrización normal crean condiciones que propician la
sepsis local. Dado que casi todos los fenómenos biológicos relacionados con la cicatrización requieren la participación activa de células, las condiciones del ambiente local deben ser óptimas para el metabolismo celular .Cualquier merma local del aporte sanguíneo retrasará o impedirá la cicatrización. Las grandes alteraciones en el riego local de los tejidos se reconocen fácilmente, pero los cambios más o menos importantes en la tensión tisular del oxígeno
pueden ser causados por factores muy sutiles .La desecación de los tejidos expuestos no solamente mata las células de la superficie, sino que también destruye el riego sanguíneo normal de los pequeños vasos a cierta distancia de la superficie. Dado que la inflamación local altera la permeabilidad de los vasos, una sutura que inicialmente circunda el tejido a baja tensión puede convertirse en un garrote que bloquea todo flujo sanguíneo local a medida que se inflaman
los tejidos lesionados .Por otra parte, la presión externa ejercida por apósitos aplicados descuidadamente puede reducirse en alto grado el riego tisular local .Para que la cicatrización progrese normalmente es preciso asegurar un riego tisular adecuado.
La gruesa capa córnea de la epidermis protege la piel intacta y los tejidos subyacentes de muchas sustancias nocivas. Cuando se lesiona la capa epidérmica, quedan expuestos los
tejidos más profundos a los errores del cirujano. Alcohol etílico, yodo, éter y otros preparados utilizados con frecuencia en solución sobre la piel intacta producen efectos mínimos. Sin embargo, los mismos productos derramados sobre una herida abierta causan la muerte de las células. Es importante proteger las heridas abiertas de todas las sustancias que entrañan un peligro para la vida de las células. Consideramos útil la siguiente regla empírica: Nunca ponga
sobre una herida nada que no pueda colocar sin riesgo sobre su propia conjuntiva Como ya se dijo fragmentos de tejidos muertos hematomas, cuerpos extraños y acumulación de líquidos actuan como barreras físicas que impide la penetración normal de los fibroblastos. Las lesiones que ocupan espacio prolongan la inflamación , estimulan la proliferación bacteriana y demoran el aumento de resistencia. Por lo tanto, figuran como objetivos primarios para el buen tratamiento de
las heridas la extirpación cuidadosa de todos los materiales muertos y la prevención de acumulaciones de líquido. Los fragmentos de tejido y los cuerpos extraños adheridos a la superficie de la herida pueden eliminarse mediante irrigación de solución salina. Sin embargo, cabe establecer como regla que las heridas traumáticas sucias deben desbridarse con el mayor cuidado mediante el uso de pinzas, instrumentos, puntiagudos y, sobre todo, tiempo. Las heridas abdominales
que cicatrizan por primera intención, las extremidades funcionales y las cicatrices faciales estéticamente aceptables son las compensaciones para el cirujano de las horas dedicadas al desbridamiento meticuloso de las heridas traumáticas ,mientras que al cirujano poco cuidadoso le esperan infecciones, fibrosis, cicatrices hipertróficas y granulomas por cuerpos extraños. Para la decisión del material de sutura.
¿Cuánta
resistencia es necesaria? ¿Durante cuánto tiempo debe la sutura proporcionar resistencia mecánica? Dado que la adquisición de nueva resistencia y la remodelación de las heridas ocurre lentamente, las uniones de tejidos que requieren resistencia inicial y prolongada deben obtenerla de materiales de sutura que permitan conservarla durante el periodo deseado. Además los tejidos coactados deben poseer suficiente resistencia mecánica para producir el resultado deseado.
Aunque
se dispone de diversos materiales sintéticos absorbibles, la sutura de este tipo usada con más frecuencia es el catgut (preparado de colágena a base de submucosa del intestino de oveja).
El catgut simple no curtido retiene su resistencia durante tres semanas , aproximadamente, según el medio local.
|

|
|
Fig. #10
|
Resistencia postoperatoria fascial a la rotura
Es difícil determinar cuánta resistencia debe proporcionar una sutura en cada caso específico.
Como ya se dijo, la mayor parte de las heridas adquieren menos del 15 % de su resistencia final a la tracción durante tres semanas, y si este grado de integridad física es suficiente, procede utilizar
suturas absorbibles. Si el material de sutura debe proporcionar cantidades apreciables de resistencia a la herida durante largos periodos, estarán indicados materiales no absorbibles.
En el momento en que se produce el alta hospitalario (antes del séptimo día ) , la resistencia de la fascia es aproximadamente del 5 % . A la tercera semana (al final de la fase de síntesis de colágeno) es aproximadamente de un 25 %.
A
las 6-8 semanas se ha incrementado hasta un 40 % aproximadamente28-34. La resistencia final de la herida es aproximadamente del 50-70 % de la resistencia facial original del tejido no lesionado.
La curva de la recuperación de la resistencia cutánea es paralela a la de la fascia . En el momento de producirse la alta hospitalaria (antes del séptimo día) sólo existe aproximadamente un 5% de la resistencia cutánea
original. Estos hechos repercuten sobre las técnicas de sutura cutánea 28.
En muchas situaciones clínicas, incluyendo la mayor parte de las incisiones abdominales, 15 % de la resistencia final a la tensión puede ser suficiente para tolerar el esfuerzo normal.
|

|
|
Fig. #11
|
Comparación de resistencias a la tensión de diversos materiales de sutura de uso frecuente.
Las características más importantes a la hora de elegir un material de sutura para cerrar una incisión facial abdominal son la resistencia a la tensión y el tipo de material . La resistencia a la tensión de la sutura debe ser capaz de mantener unidos los tejidos que
reparan y permanecer in situ hasta que dichos tejidos hayan recuperado su máxima resistencia. El material de sutura debe ser mínimamente reactivo con el fin de no obstaculizar la síntesis y maduración del colágeno.
Entre las suturas más frecuentes, el nylon (poliamida), el Prolene (poliolefinas), el PDS (polidioxónanona) y el Maxón (polímero del ácido poliglicólico) proporcionan una resistencia excelente a la tensión y
se asocian a mínima reactividad. La resistencia a la tensión de estos materiales de sutura es aproximadamente la mitad de la del acero y permanecer en la herida hasta que la fascia ha recuperado la totalidad de su resistencia a la tensión 7-28-34
La resistencia a la tensión del Prolene permanece prácticamente sin cambios después de un año . La del nylon disminuye hasta aproximadamente un 80% al final de la octava
semana, permaneciendo aproximadamente a dicho nivel durante el resto del primer año.
Las suturas de reabsorción lenta (PDS y Maxon) se reabsorben por hidrólisis y frente a las suturas no reabsorbibles gozan de la ventaja de no dejar material extraño en la herida. El PDS conserva aproximadamente un 60 % de su resistencia original al final de la cuarta semana, disminuyendo a la décima semana a aproximadamente un 10% El Maxon
mantiene aproximadamente un 40% de su resistencia a la tensión a las seis semanas.
Un factor adicional determina la magnitud de la resistencia requerida. Como es sabido, el dolor inhibe la actividad plena de casi todos los músculos voluntarios.
Evitando realizar los sobre esfuerzos bruscos en etapa conscientes, limitado por el dolor. No asi cuando el paciente se extuba al término de una
anestesia y por el reflejo de la tos se produzca sobre tensión o ruptura de los hilos de sutura en los cierres de hernias o de pared abdominal.
Resulta preferible utilizar suturas del 0 o 1, no debido a su mayor resistencia a la tensión, sino debido a su menor tendencia a contar el tejido en comparación con suturas de menor calibre. La tendencia de una sutura a cortar el tejido, es decir, la presión por unidad de superficie, es
inversamente proporcional al diámetro del material de sutura.
Se ha demostrado que las heridas reparadas con Prolene se asocian a menor índice de infección en comparación con las heridas repadas con nylon multifilamento .Las heridas reparadas con ácido poliglicólico se asocian al menor índice de infección (18%), factor que se atribuye a las propiedades bacteriostáticas de los productos de degradación de este material. Este
hecho podría constituir una ventaja de las suturas de ácido poliglicólico de reabsorción lenta.
El nylon, el Prolene, el PDS y el Maxon parecen comportarse de forma similar, y su selección parece basarse más en la experiencia personal que en ventajas clínicamente significativas.
Las suturas de reabsorción precoz, como los derivados del ácido poliglicólicos, proporcionan una
resistencia a la tensión de aproximadamente un 10% a la tercera semana, lo que resulta claramente inadecuado para la reparación de las fascias.
Dado que la sutura no absorbibles e incluso el nilón o el hilo metálico monofilamentoso pueden actuar como nido para la infección, deben preferirse materiales absorbibles en las heridas contaminadas o potencialmente contaminadas7-28-34.
Sin
embargo, los materiales absorbibles producen reacción más intensa. Cuando se desea reacción mínima se aconseja utilizar materiales no absorbibles.
En conocimiento cabal de la biología de la cicatrización de las heridas proporciona un enfoque lógico respecto al momento en que deben quitarse los puntos de sutura.
Como ya se dijo, las células epiteliales de piel emigran hacia suturas,
produciendo inflamación y abscesos estériles. Además , las suturas cutáneas que permanecen durante largo tiempo tienden a lesionar la piel subyacente, creando cicatriz adicional. Por tanto, cuando tiene importancia el efecto estético, deben quitarse cuanto antes los puntos de sutura de la piel. Puede obtenerse resistencia adecuadas para prevenir la dilatación de la herida durante el proceso de remodelado mediante colocación permanente de suturas subcuticulares
profundas en la porción más inferior de la dermis. Cuando el factor estético no constituye problema, las suturas cutáneas deben permanecer en su lugar hasta que se produzca vigor suficiente para resistir la tensión local de los tejidos y el efecto de traumatismos menores. El momento apropiado varía ampliamente en distintas regiones del cuerpo y en diferentes individuos. Por ejemplo, las tensiones ejercidas sobre un desgarro horizontal simple del párpado superior son
mínimas y la resistencia lograda por las bandas de fibrina y la epitelización suelen bastar para prevenir la dehiscencia, por lo que es posible quitar los puntos en 24 a 48 horas. En contraste, una herida vertical en la porción dorsal del tórax puede necesitar hasta 21 días para adquirir resistencia suficiente que le permita resistir la tensión del tejido local y la producida por los movimientos del cuerpo. En caso de duda, es útil quitar algunos puntos y probar con
sumo cuidado la resistencia de la herida.
Las células epiteliales no emigran sobre superficies compuestas de materiales muertos ni sobre tejidos sometidos a enormes cargas de bacterias. Las heridas en granulación y en espera de epitelización deben conservarse libres de materiales muertos; para ello es sumamente útil el desbridamiento cuidadoso con piezas e instrumentos de corte.
Las
células emigrantes y las superficies recientemente epitelizadas deben ser protegidas de traumatismos mecánicos. Por otra parte, el tejido cicatrizal epitelizado y los injertos cutáneos frescos son muy susceptibles a la invasión bacteriana. A medida que se forman costras y se producen pequeños abscesos en la suturas, deben eliminarse mecánicamente.
Las heridas recientes cubiertas con injertos de espesor parcial o completo se
contraen y remodelan con el tiempo, la magnitud de la contracción es pequeña. Las heridas que permanecen abiertas durante periodos prolongados se contraen al máximo, y el único medio eficaz en la actualidad para prevenir la contracción es la protección temprana. Las heridas que se abren de nuevo después de varios meses de la incisión inicial adquieren resistencia a un ritmo más rápido que las heridas primarias.
Cuando es
deseable la adquisición rápida de nueva resistencia, no procede resecar las viejas incisiones; por el contrario, la nueva incisión debe ejecutarse sobre la antigua cicatriz. Además, como las heridas cambian de color, tamaño y resistencia con gran lentitud, debe demorarse la revisión de las cicatrices y de los métodos de reconstrucción hasta que la reactividad cicatrizal sea mínima.
Las cicatrices voluminosas y prominentes
tres meses después de la lesión pueden tornarse lisas, planas y apenas visibles al cabo de un año, por lo que cuando se proyecta la ejecución de técnicas estéticas o reconstructivas la paciencia destaca como una virtud.
En presencia de gran número de zonas de tejidos muertos o bien cuando éstas son demasiado pequeñas para la limpieza mecánica, puede producir desbridamiento eficaz los apósitos alternantes secos y húmedos.
Sin embargo, se aconseja gran cautela en la aplicación de apósitos sobre heridas en trance de epitelización.
Diversos estudios han demostrado el efecto beneficios del tratamiento oclusivo sobre la cicatrización de las heridas .
Dicho efecto se a observado en distintos etapas del proceso de curación de las lesiones, como la estimulación de la neoangiogénesis, la granulación y la
posterior epitelización.
El enfoque terapéutico de las lesiones dérmicas ha cambiado últimamente, el concepto de dejar las lesiones expuestas al aire y cubrirlas con simples apósitos, absorbentes ha dado paso al concepto de cura oclusiva en medio húmedo. En este ámbito se han desarrollado films de poliuretano, hidrogeles semi oclusivos y apósitos hidrocoloides oclusivos. Los mismos que ejercen una absorción y retención del
exudado, controlando la cantidad del mismo entre el apósito y la lesión . Están constituidas por sustancias hidrocoloides (gran afinidad por el agua) que junto con el exudado de la lesión crean un gel que mantiene un ambiente húmedo que favorece la cicatrización y protege de la infección.
En otro campo a fin de ahorrar tiempo para el cambio del instrumental y minimizar el daño término de los tejidos, causado por la
frecuencia monopolar alta se han desarrollado nuevos instrumentos electroquirurgicos en donde se integran 4 funciones: corte bipolar, coagulación monopolar, succión e irrigación. Experimentos invitro demostraron que las extensas alteraciones térmicas creadas por el corte bipolar fue menor que el de corte monopolar en hígado de cerdo fresco y en recto de bovino. La escara severa para carbonización, coagulación y vacuolación en mucosa resecada obtenida durante la
operación en animales en vivo por el procedimiento bipolar fue 2.09, 2.27 y 1.36. respectivamente mientras que lo obtenido usando la técnica monopolar fue 2.64 , 2.82 y 2.36 respectivamente con los nuevos dispositivos se reduce el tiempo de operación esto se atribuye: Al reducir el tiempo necesario para cambiar el instrumento con que se realiza la hemostasia ,con el beneficio de reducir el daño a los tejidos reduciendo probables complicaciones 22.
La
elevación de la BCAA. (Bronched- chain amino ácido) en los niveles de glucosa sostenido a través de la hiperalimentación que se consigue en el posoperatorio usando la función gastrointestinal con seguridad puede ayudar a mejorar la cicatrización de las heridas y la resistencia a la sepsir36.
Control del Proceso de Cicatrización
Existen
situaciones en las cuales el cirujano desea ejercer cierto control sobre el proceso de cicatrización. Por ejemplo, un método eficaz para incrementar el ritmo de adquisición de nuevas resistencia podría evitar la abertura y evisceración, complicaciones desastrosas de la cirugía abdominal. El aumento del ritmo de epitelizanción en las heridas abiertas reduciría la mortalidad en pacientes quemados. El control eficaz del proceso de remodelado podría garantizar el
funcionamiento normal después de lesión tendinosa, prevenir la estrechez fibrosa del esófago después de quemaduras por lejía y eliminar la estenosis de los órganos huecos, y lo que es todavía más importante, el mismo proceso observado durante la cicatrización de las heridas parece estar implicado en una gran variedad de enfermedades humanas.
En efecto, cirrosis hepáticas, fibrosis Retroperitoneal, contractura de Dupuytren,
fibrosis pulmonar intersticial, epilepsia postraumática, enfermedad válvular reumática y una serie interminable de procesos patológicos del hombre se deben a la producción inapropiada de tejido fibroso, serían muy valiosos los métodos eficaces para controlar la formación de la cicatriz.
En efecto, el polvo desecado de cartílago procedente de muchas especies produce incremento manifestó de la resistencia de la heridas del
hombre y animales
Datos recientes sugieren que polímeros de N-acetil glucasamina quizá sean el agente eficaz (40). En siete días , las heridas tratadas con cartílago adquieren un 20 % más de resistencia que los controles.
Se desconoce el mecanismo de acción del cartílago. Sin embargo, estudios histológicos sugieren que la densidad de los fibroblastos y la formación de colágena
están aumentadas durante las fases tempranas de la reparación. El polvo de cartílago, implantado en esponjas de polivinilo, estimula la producción rápida de colágena.
Aunque el aporte de cantidades supernormales de ácido ascórbico, proteína o metionina no acelera la ganancia de resistencia, el incremento de la tensión local de oxígeno estimula notablemente la cicatrización. Las heridas de animales en un ambiente con 40%
de oxígeno poseen más resistencia al cabo de siete días que las de los animales que respiran aire 43.
Por desgracia, ni el polvo de cartílago ni el aumento de la tensión de oxígeno incrementan la ganancia de resistencia en grado suficiente para satisfacer a la mayoría de los clínicos.
Aunque son de utilidad clínica limitada, las heridas pueden ser inducidas a adquirir
resistencia más rápidamente. Dado que la resistencia final de las cicatrices depende de las moléculas de colágena , la densidad de entrecruzamiento de las fibras, los agentes que influyen en el metabolismo de la colágena ejercerían efectos importantes sobre la cicatrización. En términos generales, los agentes que sabemos afectan la formación de enlaces cruzados de la colágena son inespecífico y tóxicos para aplicación clínica.
Sin
embargo, si el ritmo de la formación de enlaces cruzados es determinado, incluso en parte, por reacciones enzimáticas, podrían encontrarse agentes farmacológicos que modificarán la velocidad de dicha formación y que podrían influir notablemente en la resistencia de la herida.
Durante el remodelado de los huesos, los cambios del campo eléctrico local parecen influir en formas manifiestas en la arquitectura de la matriz ósea.
La
tensión y el esfuerzo producen al parecer alteraciones significativas en el metabolismo de la cicatriz , pero hasta la fecha es poco lo que sabemos para utilizar estas modalidades en forma lógica4.
Aunque desde luego son deseables métodos que permitan la aceleración efectiva de la cicatrización de las heridas, podrían ser más beneficiosas para el hombre las técnicas de inhibición del proceso fibrótico. La
fibrosis patológica produce cambios fisiopatológicos importantes al alterar la forma o las propiedades físicas del tejido. En condiciones normales, las flexibles válvulas cardiacas, que adquieren rigidez por la cicatriz, se tornan incompetentes. El intestino dispensible sustituido por tejido cicatrizal duro y firme subyacente se convierte en un conducto funcionalmente ineficaz.
Por tanto, los métodos de prevenir la síntesis de
colágena o de modificar las propiedades físicas de sus fibras podrían invertir o prevenir los cambios fisiopatológicos.
Las técnicas utilizadas deben ser específicas en sus efectos sobre la colágena y selectivas en sus efectos sobre el tejido cicatrizal. Todos los inhibidores metabólicos de la síntesis de proteína (puromicina, actinomicina D ) reducen la síntesis de colágena. Por desgracia, inhiben también la síntesis
de otras proteínas; el efecto es inespecífico y desde luego tóxico para las células vivas.
Sin embargo, puede ocurrir selectivamente si son interferidos los procesos metabólicos específicos para colágena. Como ya indicamos, la hidroxilación de prolina es un proceso exclusivo. La actividad de PPH requiere oxígeno molecular, alfa cetoglutarato, ácido ascórbico y hierro ferroso. No existe método alguno para producir
escorbuto de inmediato, pero la alteración del metabolismo del hierro ferroso ejerce efectos profundos sobre la síntesis de colágena. En preparaciones de cultivos de tejidos, los quebrantes de hierro ferroso inhiben específicamente la síntesis de colágena sin afectar el metabolismo de las proteínas no colágenas 10 y lo que es todavía más importante, la administración general de los quelantes de hierro en animales impide la fibrosis hepática inducida por
sílice, altera el contenido de colágena en esponja implantada de polivinilo y reduce notablemente la resistencia de la herida 9-10. Otras técnicas diversas pueden inhibir específicamente la síntesis de colágena. Debido a que el oxígeno utilizado en la hidroxilación de prolina procede del oxígeno molecular, las células que crecen en una atmósfera de nitrógeno no hidroxílan la protocolágena, por lo que cesa la secreción de colágena. Esa técnica
carece de futuro en medicina clínica. In vivo son objeto de controversia 10.
Sabemos hoy que es posible modificar las propiedades físicas de las cicatrices sin afectar el ritmo de síntesis de colágena. Como ya se dijo, las fibras de colágena adquieren su enorme resistencia a la tensión por formación de enlaces cruzados covalentes intermoleculares. Ciertos compuestos, los osteolatirógenos, inhiben específicamente
los enlaces covalentes intermoleculares en la colágena nuevamente sintetizada. El beta- aminopropionitrilo (BAPN), compuesto encontrado en los tallos y semillas de plantas del género Lathyrus, impiden la formación de aldehidos derivados de lisina. Por influencia de los latirógenos, las moléculas de colágena son sintetizadas y excretadas a ritmos normales, pero las fibras agregadas no forman enlaces cruzados. Por tanto, la colágena latirógena posee escasa resistencia a
la tensión y se desgarra fácilmente.
La penicilamina, un quelante poderoso del cobre liberado durante la hidrólisis alcalina de la penicilina, es latirógena la penicilamina produce quelación de los aldehidos resultantes.
En animales, la administración de beta- aminopropionitrilo o penicilamina inhibe la ganancia de resistencia de las heridas incisas.Impide o invierte los cambios
fisiopatológicos en modelos de anumales con enfermedad bibróticas.
El Latirismo inducido evita la inmovilidad en la articulación rígida, mejora el deslizamiento después de lesión tendinosa, previene la estenosis del esófago como consecuencia de quemaduras por lejía y restablece el diámetro esofágico en las estenosis fijas 30. Es todavía muy escasa la experiencia con beta-aminopropionitrilo en el hombre, pero su
administración inhibe la formación de enlaces cruzados intermoleculares en la colágena cicatrizal.
No se ha demostrado todavía si los agentes latirógenos modifican la fisiopatología en el hombre.
Cada uno de los agentes anticolágenos mencionados afecta el metabolismo de la colágena específicamente. Sin embargo, para ser clínicamente eficaces no basta con la especificidad, sino
que deben afectar selectivamente la cicatriz.
El tejido cicatrizal que se modifica o cambia unas cinco veces más rápidamente que el tejido normal responde en forma selectiva a periodos breves de terapéutica anticolágena.
Se han llevado estudios con extractos cepax, heparina sódica, alantoina, ungüento con base de seral para el tratamiento de cicatrices hipertificas. Queloides de
diversas etilófios con aceptables resultados 37.
Desde el punto de vista teórico, cualquier padecimiento fibrótico en el que concurran los siguientes criterios podría tratarse eficazmente con agentes anticolágenos: 1) La fisiopatología debe guardar relación directa con alteraciones en la forma o las propiedades físicas de los tejidos fibróticos. 2 ) El índice de depósito o recambios de nueva colágena debe ser
netamente más alto en los tejidos enfermos que en los normales, 3) La formación de tejido fibroso patológico debe quedar restringida a un periodo breve. Resulta interesante el hecho de que en muchos problemas quirúrgicos frecuentes concurre estos criterios.
Hasta la fecha, no se ha logrado un control eficaz del proceso de cicatrización en el hombre. Sin embargo, datos experimentales sugieren que dicho control es factible. Es
seguro que con el tiempo surgirán métodos clínicamente útiles para controlar la formación de la cicatriz y la contracción de las heridas, pero hasta que dispongamos de instrumentos tan eficaces, el cirujano debe utilizar la información biológica considerada en este capítulo para lograr el funcionamiento máximo de las partes lesionadas.
Pronóstico de la Cicatrización de las Heridas
El
pronóstico de la cicatrización de una herida es un tema de gran importancia, no sólo para el paciente, sino también para el cirujano. Para el paciente, una cicatriz inestética es no sólo un motivo constante de preocupación y complejos de inferioridad, sino que también puede disminuir sus posibilidades labores, sobre todo en un tipo de empleo que requiera trato frecuente con el público, ya que muchas personas tienden a sentirse incómodas e incluso molestas ante
alguien que tenga un aspecto desagradable. Para el cirujano, una cicatriz pudiera ser el único indicio, similar a una <marca registrada>, de la operación por él realizada.<sereís juzgados por vuestras cicatrices>
Es así que con meticulosidad y cuidado, usando material fino y agujas atraumáticas de pequeño diámetro, se consiguen cicatrices inaparentes. Con tales técnicas se puede en algunos casos conseguir este
resultado, pero no en otros. La cicatriz puede ser buena, pero también mediocre o desastrosa a pesar de la mejor técnica quirúrgica ejecutada por los mejores cirujanos 6.
Cicatrices Atróficos
Estas cicatrices contraidas, retraídas situadas por debajo del nivel de la piel, se originan cuando una herida cicatriza de modo tan deficiente que se
reconstituyen muy pocas fibras de tejido conjuntivo.
Después de forunculosis y acné conglobata frecuentemente se origina cicatrices retraídas en forma de embudo. La formación de la cicatriz se verifica a continuación de la inflamación y se desarrolla a lo largo del conducto de salida de las glándulas sebáceas.
|

|
|
Foto #4.- Queloides. Sitio de Vacunación.
|
Queloides y Seudoqueloides
Antes de proseguir analizaremos brevemente la diferencia entre un queloide y una cicatriz queloidea o seudoqueloide. Ambas son semejantes en el examen microscópico, ya que las dos son cicatrices hipertróficas. Clínicamente, un queloide verdadero es una cicatriz hipertrofica que continúa aumentando más allá del tamaño y forma
origínales de la herida. El queloide, aunque más frecuente en individuos de raza negra, puede ser hallado en pacientes de cualquier raza que tengan tendencia a la formación del mismo. Una cicatriz queloidea puede aparecer en cualquier raza y puede producirse en cualquier herida que esté sometida a excesiva tensión. El diagnóstico diferencial es importante, dado que el tratamiento de un queloide verdadero difiere del indicado para una cicatriz hipertrofica seudoqueloide,
los resultados del tratamiento de los queloides verdaderos son frecuentemente insatisfactorios.
A veces no es fácil discernir la diferencia entre un queloide y una cicatriz queloidea.
No existen métodos clínicos exactos para determinar con certeza estas dos posibilidades clínicas.
Factores más importantes en el
Pronóstico de la Cicatrización
Contrariamente a la creencia general, la calidad de la cicatriz no está determinada tanto por la técnica de sutura cuarto por la forma en que produjo la herida. En el momento de la producción de la herida existen una serie de factores que influirán sobre los resultados estéticos de la cicatriz. Entre ellos, los tres más importantes son , por orden decreciente: 1) la región donde se sitúa
la herida:2) el curso o dirección que sigue en relación con las RSTL, y 3) su longitud.
Región del Cuerpo
La región en donde se localiza la herida es el factor más importante en la calidad de una cicatriz. Existe dos zonas notorias por su tendencia a la formación de cicatrices inestéticas: la región esternal y la región del hombro
(delto-acromio-escapular).
|

|
|
Foto #5.- Cicatriz Inestética Esternal.
|
Antes de efectuar una incisión de dicha zona, ya sea para extirpar un tumor o para lograr acceso a estructuras más profundas, debemos informar al paciente de que la cicatriz será probablemente insatisfactoria desde el punto de vista estético; que podrá ensancharse e hipertrofiarse.
La causa principal de esto es la gran tensión cutánea que existe en estas zonas en todas direcciones. Este
fenómeno se manifiesta claramente en la región esternal por la forma en que se separan los bordes de las heridas producidas a este nivel. Es posible que este aumento de tensión sea debido a la tracción sobre la piel de la región esternal producida por el aumento de volumen de las mamas durante el desarrollo, y por la expansión de la pared torácica durante la respiración. El aumento de tensión en la región del hombro se debe a la tracción resultante de la posición
pendiente habitual de la extremidad superior.
Solo en casos muy excepcionales estará indicada la revisión de una cicatriz en estas regiones. Las probabilidades de mejoría son mínimas y las posibilidades de empeoramiento son grandes.
Aunque no tan evidente, existe aún otra pequeña región, la zona lateral submandibular, en la cual las cicatrices son hipertróficas. En las regiones
braquial, antebraquial, glútea, femoral y crural las cicatrices tienden también a ensancharse y, en ocasiones, llegan a ser hipertróficas.
La palma de la mano, la planta del pie, el pene, el escroto y las membranas mucosas generalmente sanan con menos cicatrices visibles que las de otras regiones. Esto probablemente sea debido a la poca tensión que existe en los tegumentos de estas regiones.
Las
heridas en detalles o estructuras anatómicas o próximas a ellos, como cejas, pestañas, labios, alas de la nariz y cabello, deben ser tratadas con cuidado extraordinario. En estos lugares , cualquier desviación de un resultado óptico puede producir efectos desproporcionadamente desagradables.
Las heridas en las mucosas curan mejor, con menos cicatriz que en la piel, probablemente debido a la poca tensión que existe en las
mucosas. Excepción inestética a esta regla general serán las heridas contusas que atraviesan oblicuamente el borde libre de los labios, dando origen a abultamiento desfigurantes.
Dirección o Curso de la Herida
Cuanto más fielmente sigue una herida las líneas de tensión (RSTL) , mejor es el resultado estético y funcional 6.
Cuanto
más perpendicular la incisión a las RSTL, más anchas, y probablemente hipertrofica, será la cicatriz. Si en ciertos casos y en ciertas zonas una herida antitensional (antitensión line, ATL) da un resultado aceptable, o incluso bueno.
Las incisiones quirúrgicas electivas deben ser siempre proyectadas con vistas a seguir las RSTL de la zona.
Uno de los beneficios básicos en los
métodos de revisión de las cicatrices es que la cicatriz puede ser modificada de tal forma que quede en una orientación más acorde con la dirección de las RSTL.
|

|
|
Foto #6.- Disposición líneas RSTL.
|
El valor pronóstico de la forma de una herida, como los dos factores mencionados anteriormente, está relacionado con la tensión cutánea. Hemos dicho ya que las heridas lineales rectas que siguen las RSTL pueden curar con cicatrices excelentes; sino siguen estas líneas, la cicatriz se hace inestética. Las cicatrices en líneas quebradas son, generalmente, superiores a las rectilíneas antitensionales, debido, principalmente, a que
algunos de sus componentes probablemente van a coincidir con las RSTL, y porque disfrutan de una elasticidad, a la manera de un acordeón, ante la tracción aplicada entre sus extremos.
Las heridas curvas, en herradura o en U, son notablemente antiestéticas, porque dan lugar a la llamada deformidad <en trampilla>. Esta cicatriz, cuando se retrae, forma una depresión, creando un surco curvado, y la piel que se encuentra
dentro de este surco tiende a abultarse.
Longitud de la Herida
Es cierto, habitualmente, que cuanto mayor número de cicatrices existan en una región, mayor será el grado de deformidad. Sin embargo, la experiencia ha demostrado que en pacientes que tienen un gran número de cicatrices por heridas pequeñas pueden ser estéticamente más satisfactorias que
una cicatriz larga, rectilínea producida por una herida larga antitensional. Las pequeñas cicatrices no tienen el efecto de <cuerda de arco> de una cicatriz larga. Más aún, las pequeñas cicatrices se hallan separadas unas de otras por zonas de piel sana, de elasticidad normal, lo cual contribuye a la elasticidad conjunta de la región. En general, cuanto más pequeña es la herida, menor y menos desfigurante será la cicatriz.
Una
cicatriz larga, antitensional, compuesta de pequeños segmentos orientados en diferentes direcciones, en forma de acordeón, será superior a una cicatriz rectilínea, antitensional, de la misma longitud total. La cicatriz en línea quebrada no se deprime tan fácilmente como la rectilínea, la cual tiene mayor tendencia a traccionar (a la manera de una cuerda de arco), como resultado de la uniforme distribución de la fuerza en una sola dirección. Así, las técnicas de Z-
y W -plastia tienen un doble efecto: por un lado, mejoran la dirección de una cicatriz lineal antitensional (ATL), y por otro rompen la cicatriz en segmentos, previniendo la aparición del efecto de <cuerda de arco>.es importante mencionar una excepción a la regla de que la cicatriz será satisfactoria si sigue las RSTL. Si una cicatriz, aunque siga las RSTL, es excesivamente larga o circunscribe una extremidad, dará lugar a un excesivo grado de retracción y a un
aumento excesivo de tensión en la dirección de la RSTL, lo cual actuará deprimiendo la cicatriz. Las cicatrices largas en la cara, aunque sigan las RSTL, pueden no ser aceptables desde el punto de vista estético.
Otros factores que influyen sobre la Cicatrización
Ángulo entre el plano de la herida y la superficie cutánea. Las incisiones
perpendiculares a la superficie cutánea dan mejores resultados. Cuando más agudo sea el ángulo, mayor será la zona de afectación dérmica. La cicatriz epidérmica en si puede ser mínima e inaparente, pero la retracción de la ancha cicatriz dérmica causará un abultamiento de la piel, y cuanto más gruesa sea la piel , mayor será este efecto. Así, en los párpados la deformidad podrá ser insignificante, pero en la frente será considerable.
Este
factor contribuye a menudo a la deformidad de las cicatrices en U. Consecutivas a heridas en las cuales el agente causal sigue dirección tangencial a la superficie cutánea. En cirugía solamente se pueden permitir este tipo de incisiones oblicuas cuando el cirujano quiere preservar la integridad del folículo piloso con vista a obtener piel gruesa, con pelo, para injertos, o cuando se hace una incisión quirúrgica a través de una región con pelos.
|

|
|
Fig. #12 Arriba: herida de dirección oblicua a la superficie cutánea. Abajo: Deformidad resultante después de la curación de la herida y retracción de la cicatriz.
|
Profundidad de la Herida
Para que una herida produzca una cicatriz permanente debe seccionar o destruir la capa papilar del corion 6-7. De otro modo, sólo se producirá una marca temporal, en la cual el área aparecerá más sonrosada por comparación con la zona circundante. Esto ocurre, por ejemplo, cuando la piel es lesionada por dermoabrasión.
Una
herida que interesa estructuras más profundas que la piel y tejido subcutáneo tiene mayor posibilidad de ser desfigurante. Esto ocurre porque la tracción hacia la profundidad del tejido cicatrizal en las estructuras subyacentes se suma a la producida en la piel, acentuando así la depresión. Este efecto pernicioso de la cicatriz profunda es minimizado cuando se practica una Z- o W plastia dado que en el postoperatorio no coincide la cicatriz de los planos profundos con la
del tegumento; se evita esta adición de efectos.
Técnica Quirçurgica.- No hay ni que decir que la técnica quirúrgica asume un papel importante en la obtención de los mejores resultados posibles. Comprende la aproximación adecuada de los bordes cutáneos , el uso de suturas finas, la retirada precoz del material de sutura y una técnica traumática, Sin embargo, no debemos olvidar que, <la perfección quirúrgica es
en si misma la solución completa al problema de la obtención de buenas cicatrices>.
Tensión de la Piel.- Como se ha dicho anteriormente, la tensión cutánea es el factor básico que subyace en la influencia de los otros factores; región, dirección, forma y longitud de la herida. Las cicatrices están sometidas a tensión estática, que es la tensión constante que existe en la piel , y a tensiones dinámicas que las
producidas por las contracciones musculares y el movimiento de las articulaciones. Hay autores que dan gran importancia a las tensiones dinámicas en el ensanchamiento de las cicatrices, cuando, existen muchas variaciones individuales en el grado de tensión cutáneo. Por ejemplo, la tensión es mayor en el joven que en el viejo y en el gordo que en el delgado. En algunas personas de edad avanzada las líneas de arrugas se pueden producir en todas direcciones. Las cicatrice
serán satisfactorias en estos pacientes, y no porque las heridas sigan o no las RSTL o las arrugas , sino porque en una piel con profusión de arrugas la tensión cutánea es muy baja.
Cuando existe pérdida de sustancia, la tensión de la piel estará aumentada en el momento de cerrar la herida, y la cicatriz resultante probablemente se ensanchará. Antes de intentar una revisión el cirujano debe cerciorarse de que una cicatriz
amplia no es consecuencia de una perdida de sustancia tisular, en cuyo caso las únicas técnicas justificables serán las que aporten nuevo tejido al defector: de otra manera, asistiremos a una recidiva inevitable.
Como ya hemos dicho, las cicatrices muy largas, incluso aquellas que siguen las RSTL, pueden llegar a deprimirse por el aumento exagerado de tensión en la piel.
En su mayoría
son paralelas a las RSTL, y las cicatrices que las seccionen serán inestéticas. Sin embargo, condiciones (como la edad avanzada) o regiones cutáneas (escroto), que entrañan muchas arrugas, pueden dar lugar a cicatrices mucho más satisfactorias que en el caso de pocas o ninguna arruga (niño, hombro).
En personas de edad muy avanzada, en especial si han sufrido pérdidas importantes de peso, puede observarse que las líneas de
arrugas, siguen casi cualquier dirección imaginable. Las cicatrices consecutivas a incisiones que sigan la dirección de tales arrugas, sean éstas coincidentes o no con las RSTL, darán resultados aceptables muy buenos, no porque la cicatriz siga la diracción de una arruga, sino porque, como se ha dicho, la piel del anciano es ll´´accida y tiene muy poca tensión en cualquier sentido.
En los orificios (boca, conducto auditivo
externo, orificios nasales, vagina, ano), las RSTL son perpendiculares al centro de éstos, siguiendo la disposición radial. Cualquier cicatriz que no respete las RSTL en estos lugares dará origen a cierto grado de retracción.
Cuando se producen heridas en zonas pilosas (cuero cabellodo, cejas, barba) la cicatriz resultante, desprovista de pelo, resulta más evidente que en regiones lampiñas, a menos que sea posible recubrirla
con los pelos adyacentes.
Cuanto más fina es la piel, menos capacidad tiene de contrarrestar la retracción cicatrizal. Una cicatriz antitensional en piel fina (cicatriz vertical en párpados o en cara anterior del cuello) es mucho más deformante que otra similar sobre piel más gruesa (frente, cuero cabelludo, espalda). Cuando los bordes de una herida traumática o quirúrgica son de igual grosor se obtiene mejor cicatriz que
cuando son de distinto grosor.
Mecanismo de producción. Curación de la herida. Edad de la cicatriz.
Heridas contusas.- Las heridas contusas no curan tanto como las quirúrgicas o laceraciones con objeto afilado , porque en las primeras existe una importante necrosis en los bordes, lo que aumentará la cantidad de cicatriz formada. Además, las
heridas contusas pueden contener cuerpos extraños con más frecuencia.
Cuanto más corto sea el tiempo transcurrido entre la producción de la herida traumática y su reparación, menos peligro habrá de infección y de la presencia de exceso de fibrosis en la cicatriz.
Cicatrices por quemaduras.- Las cicatrices consecutivas a quemaduras profundas tiene una notable tendencia a la
hipertrofia, esto es principalmente debido al aumento en todas direcciones de la tensión cutánea en la zona quemada, por la pérdida de tejido en superficie producida por la acción del calor.
Cura por segunda intención.- La curación de una herida por segunda intención implica la formación de mayor cantidad de tejido de granulación, en el cual la cobertura definitiva se producirá a expensas de tejido cicatrizal con
una fina capa de epitelio que saltará, a modo de puente, en el espacio establecido entre los bordes cutáneos separados en un principio. Esto ocurre despúes de heridas en las que no se practicó aproximación de bordes, o en aquellas que, ya suturadas, hubieron de volverse a abrir para permitir la salida de sangre de un hematoma o el drenaje del pus de una infección. Naturalmente, tal tipo de cicatriz, más amplia y profunda, tiene peor aspecto que la que resulta de la
cura por primera intención.
Efecto del tiempo transcurrido.- Cuando evaluamos una cicatriz, es importante tener en cuenta su <edad>. La cicatrización epidérmica se completa rápidamente, pero la cicatrización de la dermis es muchisimo más prolongada. Esta maduración cicatrizal dérmica es mucho más importante como factor determinante en el aspecto definitivo de la cicatriz .
Usualmente
tiene peor aspecto entre las dos semanas y los dos meses de la producción de la herida. En aquellas cicatrices que no llegan a sufrir una hipertrofia o una transformación queloidea, se produce una disminución progresiva de la vascularización y celularidad. El color rojizo de una cicatriz joven, reciente, es debido a los vasos existentes en ella. A medida que va evolucionando, se vuelve más pálida y más blanda al disminuir su vascularización. La mayor parte de la
maduración de una cicatriz se produce durante el primer año de evolución, pero puede continuar incluso hasta tres años después de la herida. En una persona de piel clara, una cicatriz reciente, reconocible con facilidad por su aspecto rojizo, podrá llegar a ser estéticamente aceptable con el paso del tiempo.
Tipo de enfermo
Raza.- Las
cicatrices en pacientes de raza negra son más propensas a la hipertrofia que en los blancos; entre la raza blanca, los individuos rubios tienen probabilidades de cura con mejores cicatrices que los morenos. Se observa mayor tendencia a la hiperpigmentación después de abrasión dérmica, sea accidental o quirúrgica, entre los latinos.
Edad.- Las personas de edad tienden a presentar cicatrices menos visibles que las que se
observan en el adulto joven o en el niño.
Sexo.- El sexo en sí no tiene gran importancia en la formación y evolución de la cicatriz. Sin embargo, las mujeres en general se preocupan mucho más de su apariencia que los hombres, y tienden a exigir mejores resultados estéticos,
Factores individuales.- Han sido puestos al final de esta lista intencionalmente , porque con
frecuencia son considerados como si tuviesen mayor importancia de la que tienen en realidad. Se han achacado a propensión individual muchas cicatrices antiestéticas, que realmente eran debidas a uno u otro de los varios factores expuestos, erroneamente se han etiquetado pacientes de <formadores de queloides> tan sólo porque presentaban una cicatriz queloidea o hipertrófica en región esternal, hombro o línea media del abdomen, ignorando que en dichas regiones las
cicatrices se ensanchan e hipertrofian con facilidad en cualquier individuo.
En otras zonas, los mismos pacientes podían haber dado cicatrices lineales inaparentes.
La valoración de una cicatriz es un criterio subjetivo y por lo tanto consideraciones individuales subjetivas deben tomarse en consideración al evaluar el pronóstico de una cicatrización. Cada paciente tiene diferente
ocupación e intereses y juzgará el resultado final de distinta manera.
Los materiales, aparatos y técnicas usadas en la reparación de las heridas se han discutido profundamente, como Uds. Podrán observar el número de opciones disponibles es múltiple, pero no, cuantas opciones el cirujano puede escoger y su objetivo único es el restaurar la salud del paciente efectuando el menor procedimiento traumático que le fuera posible.
Bibliografía
1.
Adamsons, R. J., Musco, F., and Enquist, F.: the relationship of collagen content to wound strength in normal and scorbutic animals. Surg.Gynecol. Obstet., 119.323, 1964.
2. Adzick, Cells, matrix, growth factors, and the surgeon .tre biology of scorless fetal worend repair Ann, Surgery ful. 220 (1) 10-8 1994.
3. Altermeier ,W , al. Manual on control. of infectión in surgical. Patients,
Anerca collaje of surgeons. Philadelphia, 1976
4. Arem, A., and Madden, J. W: Effects ot stress on healing wounds: 1. Intermittent non-cyclical tension. Surg. Res., 20:93, 1976.
5. Bermudes, G. tratamiento de heridas cutáneas con aplicación de derivados de la caña de azúcar- panela .Revista Universidad Guayaquil, N° 69 (4-10) 1987.
6.
Borger, A. Cicatrices inesteticas Prevención, y tratamiento.Editorial, Labor. SA. Barcelona acp .2: 15-30- 1977.
7. Christopher, D. Tratado de patologia México 14 edt. Inter america. 1986.
8. Chvapil, M.: Zinc and wound healing. In Zederfeldt, B. (Ed.): Symposium on Zinc. Lunds, Sweden, A. B. Tika, 1974
9. Chvapil, M.: Pharmacology of fibrosis:
Definitions, limits, and perspectives. Life Sci. (1), 16: 1345, 1975.
10. Chvapil, M., Ryan, J., Madden,W., And Peacock, E. E., Jr,: Effect of chelating agents, proline analogs, and oxygen tension in vivo and in vitro experiments on hydrxylation,trasport, desgradation, and accumalation of collagen . In vogel, H.G.(Ed,): connective Tissue and Ageing, 1:195, 1973: International. Congress Series. N° .264. amsterdam, Excerpta Medica.
11.
Cohen,L.K., and Keisier, H, R.:Disruption of healed scars in scurvy - tre result of a disequilibrium in collagen metabolism. Plast. Reconstr.Sug., 57:213,1976.
12. Daly, J. M., Steigher, E., prockoo, D.J., and dudrick, s.J.: Inhibition of collagen syntresis by the proline analogue cis- 4- hydroxyproline. J.Surg. Res., 14:551, 1973.
13. Davis, W. M., Madden, J,W., and Peacock, c. E., Jr.: A
new appoach to fre control of esophageal stenosis. Ann. Surg., 176:469, 1972.
14. Dunphy, J.E., and Jackson, d.S.: Practical apptications of experimental studies in the care of primarily closed wounds. Am. J. Surg., 104:273, 1962.
15. Edlich, R.F., Panek., P.H., Rodehaver, G.t., Tunbull, G, Kurtz, L. D., and edgerton, M. T.: Physical and chemical configuration of sutures in the development
of surgical infection. Ann: Surg., 177:679, 1973.
16. Ehrlich, H.P.,and Hunt, T.K.: Effects of cortisone and vitamin A on Wound healig. Ann. Surg., 167:324, 1968.
17. Gabbiani, G., Hirschel, B. J., Ryan, G.B., Statkov, P.R., and Majno, G.: Granulation tisaue as a contractile organ: A study of structure and function. J.Exp. Med., 135: 719, 1972.
18.
Gabbiani, G., Ryan, G.B., and Majino, G.: Presence of modified fibroblasts in granulation tissue and their possible rolo in wound, contraction. Experimentia, 27. 549. 1971.
19. Hunt, T. K., Oonnlly, W. B., aronson, S. B., and Goldstein, P., Anaerobic metabolism and wound healing. A hypothesis for tre initiation and cessation of collagen aynthesis in wounds. Am. Surg., 135:328, 1978.
20.
Irvin, T.T.: Effects of malnutrition and hyperalimentation on wound healing :Surg. Gynecol. Obstet. 146: 33, 1978.
21. Juva. R.: Hydroxlation of proline in the biosyntresis of collagen .acta physiol. Scand. (suppl,), 308:1, 1968.
22. Kanehira, E, Trasanal endoscopic microsurgry usend a newy designed. Multifunctional. Bipolar cutting and monopolar, cogulating instrument- Endosc lurg
Allied.T. Apr. 1 (2);102-6. 1993.
23. Regulation of wound healing angiogenesis- effect of oxygen gradients and inspired oxygen concentration. Surgery 1981: 90: 262.
24. Knighton, D.R., K, Fiegel, V,D., etal: Stimulation of repair in chronic, nonhcaling, cutancpus ulcers using platelet-derived wound healing formula, surg.Gynecol. Obstet., 170:1990.
25.
Lee, K.H., Studies on the mechanism of action of salicylate.II. Retardation of Wound healing by aspirin.J. Pharm.Sca., 57: 1042, 1968.
26. Leibovich, S. And Ross, R.: The role of the macrophage in wound repair.Am. Pathol., 78:71, 1975.
27. Levenson,S.,And Seither, E.:Dysnutrition, wound healing and resistance to infection. Clin, Plast.Surg., 4:375, 1977.
28.
Lichtenstein ,J. et al the dynamics of wound healing Surg gynecol. Obstet- 1. 130- 638. 1976
29. Madden, J.:On the contractile fibroblast. Plast. Reconstr. Surg., 52: 291, 1973.
30. Madden, J. Davis, W. M., Butler, C., II, and Peacock, E. E., Jr.: Experimental esophageal Iye burns. 2 Correcting established strictures with B- aminopropionitrile and bougienage. Ann. Surg., 178: 277, 1973.
31.
Madden, J. Morton, D., Jr., and Peacock, E.E., Jr.: Contraction of experimental wounds: I. Inhibiting wound contraction using a topical amooth muscle antagonist. Surgery, 76: 8, 1974.
32. Madden, J.., and Peacock, E.E., Jr.: Studies on the biology of collagen during wound healing. I. Rate of collagen synthesis and deposition in cutaneous wounds of the rat, Surgery, 64. 288, 1968.
33.
Madden, J. and Simith, H., Rate of collagen synthesis and deposition in dehisced and resutured wounds. Surg. Gynecol. Obstet., 130: 487, 1970.
34. Masterson,B. Wound healing in gynecologic Surgery manual of gynecologic Surgery. 2° ed. New Jork . 71-9. 1986.
35. Mateo, R. Interleukin 6 activity in wounds Am J. Phiysiol jun: 266. 1994.
36. Moss,
g. Postoperative enteral hy peralimentation Resuelts in earlier elevatión of surum branched chain aminocid. Levels Am. J. Surgany jul: 168 (¡): 33-5 1994.
37. Navarro, N. Informe Preliminar sobre el estudio de contractubex gel para el tratamiento de cicatrices en hostital. Santo Tomás FACS. N° 1 1996.
38. Odland, G.:and Ross, R.: Human wound repair. I. Epidermal regeneration. J. Cell.
Biol., 39: 135, 1968.
39. Ordman, L. And Gillman, T.: Studies on the healing of cutaneous wounds. I.The healing of incisions through the skin cutaneous wounds. I The healing of incisions through the skin of pigs. Arch. Surg., 93: 857, 1968.
40. Prudden, J. Migel, P.,Hanson, P., Friedrich, L., and Balarsa, L., The discovery of a potent pure chemical wound- healing accelerator. Am. J. Surg.,
119: 560, 1970.
41. Rudolph, R., Location of the force of wound contraction. Surg. Gynecol. Obstet., 148: 547, 1979.
42. Sarrialho, K. Distinect. Populations of basal keratinocytes express stromelysin - 1 and stromelysin- 2- in chronic wound Jclin. Invest. Jul 94 (¡) 79- 88. 1994.
43. Stevens, F. , and Hunt, T. K.: Effect of changes in inspired
oxygen and carbon dioxido tensions on wound tensile strength: An experimental study, Ann. Surg., 173: 515, 1971.
44. Stone, P., and Madden, J. W.: Effect of primary and delayed split skin grafting on wound contraction Surg. Forum, 25: 41, 1974.
45. Stone, P., and Madden, J.W.. Biological factors affecting wound contraction. Surg. Forum, 26.547, 1975.
46.
Weeks, J., Prostaglandins. Ann. Rev. Phamacol., 12: 317, 1972.
47. White, R., Abergel, R.P., Klein, S. R., et al .: Laser welding of venotomics yr arteristamias Arch. Surg., 121: 905, 433, 1986.
|