Transfusión Sanguínea. Principios de Inmunología y Utilización de Sangre
y Derivados en Cirugía
|
|
|
Dr. Julio
Campos Saltos |
|
Dr. Jorge
Pazmiño Medina |
Utilización de Sangre y Derivados en Cirugía.
Introducción.
La
transfusión de sangre humana, ha sido y es utilizada para restituir el
fluido circulante y mantener la hemostasia. Actualmente se trabaja en
terapéutica de restitución hematológica, ya sea por necesidades o
déficit de los elementos constitutivos de la sangre, para lo cual se
usan los derivados sanguíneos como el plasma, sus proteínas,
concentrados de glóbulos rojos, concentrado de plaquetas e inclusive
fibrinógeno. (1)
La sangre
contiene sustancias inorgánicas, esencialmente constituidas por
electrólitos que se estudian en el capítulo anterior; y sustancias
orgánicas constituidas por proteínas plasmáticas. Las proteínas
plasmáticas se encuentran en una concentración de 6 a 8 g. por 100 ml,
con la siguiente proporción: suero albúmina de 4 a 6 g. por 100 ml, glo
bulinas de 1.5 a 3 g. por 100 ml y fibrinógeno de 0.2 a 0.4 g. por 100
ml (1).
Para
requerir una óptima transfusión actualmente se requiere de aceptaciones
inmunológicas receptor - donante, ya que la transfusión de sangre o la
de sus componentes celulares de un donante a un receptor es una forma de
transplante. (2)
Es necesario
tener un juicio clínico definido sopena de los beneficios y riesgos
conocidos por la transfusión sanguínea como tratamiento alternativo, por
cuanto aún en la actualidad siendo las transfusiones más seguras pueden
acarrearse posibles trastornos inmunopatológicos como transmisiones de
enfermedades, por lo que es obligatorio el consentimiento informado por
parte del paciente. (2)
| Publicidad |
|

|
Historia.
El concepto
de transfusión fue dado por Robert Dess Gabets en el año 1658. Lowel
realiza la primera práctica de una transfusión en perros en el año 1967.
Siendo Blundell quien se interesa por la transfusión en humanos al mismo
tiempo que racionalizaba su uso. Bischoff propuso la adición de
bicarbonato de sodio a la sangre en el año 1835, para evitar su
coagulación, por lo que es conocido como el pionero de la conservación
de la sangre. (3)
En el año
1900 Karl Landsteiner descubre el sistema ABO, y clasificó a los grupos
sanguíneos por la presencia de antígenos específicos en la membrana
eritrositaria llamado aglutinógeno. Además demostró que existen
anticuerpos llamados aglutininas que se hallan en el suero, pero que no
reaccionan a los aglutinógenos del mismo individuo, pero sí, a los
aglutinógenos de los eritrocitos de otro individuo, esta es la conocida
ley de Landsteiner. (4)
En 1910,
Duke reportó la eficacia de la transfusión de plaquetas en pacientes con
desordenes hemorrágicos. (3) En 1924 Bernstein señala que cada individuo
hereda dos genes ABO, uno de cada padre, y que estos genes determinarán
la presencia de los antígenos ABO en los glóbulos rojos de cada persona.
(6)
En el año
1939 Levine y Stetson publicaron un trabajo en la que una madre
terminaba de dar a luz un feto muerto y macerado y ella había
desarrollado una severa reacción hemolítica por la transfusión de sangre
de su esposo. Al mismo tiempo Landsteiner y Wiener inmunizaron conejos y
cobayos con glóbulos rojos de monos Macacus rhesus y demostraron que se
aglutinaban los glóbulos rojos de los monos rhesus por lo que fue
clasificado como suero antirhesus o Rh positivo (85%) y el restante que
no se aglutino como Rh negativo. (6)
En 1914 el
médico argentino Luis Agote realiza la primera transfusión con sangre
conservada utilizando como anticoagulante el citrato de sodio. En 1960
nace como especialidad la Medicina Transfusional, mediante la
utilización de bolsas plásticas lo que daría un vigoroso avance y
permitiría el uso de fraccionamiento de los distintos elementos
sanguíneos, sumándose a todo esto los avances de criopreservación,
filtración, recambio plasmático y leucoreducción. (7)
Antígenos
y Anticuerpos Eritrocitarios.
Los diversos
grupos sanguíneos se definen con la presencia de determinados antígenos
eritrocitarios, plaquetarios, leuocositarios y séricos. Los antígenos
son productos directos o indirectos de la actividad de los genes y se
transmiten generalmente por caracteres codominantes (de acuerdo a la ley
de Mendell), es decir, que se expresan tanto en individuos homocigotos
como heterocigotos. Los genes que intervienen en la producción de los
antígenos de cualquier sistema del grupo sanguíneo suelen ocupar el losi
equivalentes en pares de cromosomas homólogos. De ahí que se denomina
genotipo a la suma de los genes heredados, y fenotipo, al conjunto de
caracteres que se expresan en un determinado individuo. El tipo
sanguíneo de cada tipo es indeleble y hereditario, por lo que tiene
utilidad en la investigación de la paternidad, sobre la base del que
nadie puede heredar lo que sus padres no poseen. (5)
Los
antígenos sanguíneos radican su importancia, en su propiedad de
sensibilizantes y a la capacidad de reaccionar con su correspondiente
anticuerpo. (5)
Se han
definido mas de 100 sistemas de grupos sanguíneos formados por más de
500 antígenos. (8) Entre ellos existen algunos (denominados públicos o
de alta incidencia) es decir que están presentes en casi todos los
individuos, mientras que otros son raros (denominados privados o de más
incidencia). En la tabla S.1 se exponen los grupos eritrocitarios más
importantes. (5)
RTH:
Reacciones transfusionales hemolíticas.
EHRN:
Enfermedad hemolítica del recién nacido.
El
conocimiento de los antígenos y anticuerpos eritrocitarios son de
importancia, especialmente en la prevención y tratamiento de las
reacciones transfusionales y de la enfermedad hemolítica del recién
nacido (EHRN). La mayoría de los antígenos eritrocitarios se hallan bien
expresados en el recién nacido (Rh, Kidd, Duffy, MN), otros se expresan
más débilmente que en el adulto (A,B) y algunos están prácticamente
ausentes (Lewis I). (5)
Los
anticuerpos eritrositarios están constituidos por inmunoglobulinas,
fundamentalmente IgG, IgM y más raramente IgA. Cuando los anticuerpos
eritrositarios reconocen antígenos que no pertenecen al individuo que
los ha producido se las denomina aloanticuerpo. Cuando las
inmunoglobulinas reaccionan contra antígenos presentes en los propios
ematíes reciben el nombre de autoanticuerpo. (Son entidades de
entendimiento único de los hematólogos que estudian las anemias
hemolíticas adquiridas).
Existen dos
grupos de aloanticuerpos: espontáneos o naturales y adquirido o inmunes.
Los aloanticuerpos espontáneos o naturales son aquellos en los que no
puede demostrarse el estímulo antigénico que han desencadenado su
formación, siendo regulares los que son de observación constante en los
individuos que no poseen el antígeno correspondiente. Ejemplo de estos
son las aglutininas anti-A y anti-B. Los anticuerpos naturales y
regulares son los que no aparecen de manera constante.
Se llaman
aloanticuerpos adquiridos o inmunes aquellos que se producen como
respuesta a un estimulo antigénico provocados por transfusiones o
embarazo. (5)
Los
aloanticuerpos naturales son generalmente inmunoglobulinas de tipo IgM,
o sea moléculas de gran tamaño que no pueden atravesar la barrera
placentaria. Los aloanticuerpos inmunes son inmunoglobulinas de tipo
IgG, que atraviesan la barrera placentaria y son los responsables de la
EHRN, en casos de incompatibilidad feto materno. (5)
Sistema
ABO.
Una
característica de este sistema es que en el suero de cada individuo se
encuentran de manera constante, anticuerpos que reaccionan con los
antígenos ausentes en sus hematíes. El sistema ABO intervienen tres
genes alelomórficos denominados A,B y O ubicados en el cromosoma 9. Los
genes A y B del sistema ABO son codominantes y codifican glucosil
transferasa que agregan N- acetil galactosamina o galactosa,
respectivamente, a un antígeno H precursor (9), que le confiere la
especificidad antigénica final, A o B. El gen O produce una enzima sin
actividad de modo que solo hay antígeno H, de tal manera que no produce
modificaciones a la sustancia H. Los hematíes del grupo O se encuentran
grandes cantidades de sustancia H. Los pacientes con sangre de tipo O
reconocen los antígenos A o B como extraño y tienen anticuerpos anti - A
y anti - B. (9) (8) (1)
De esta
manera los seres humanos se clasifican en cuatro grupos en el sistema
ABO, ya sea por la presencia o ausencia en sus eritrocitos de los
aglutinógenos A y B, que pueden existir juntos o separados. (1)
Los
anticuerpos anti - A y anti - B se denominan isoaglutininas. Las
personas del grupo A tienen el antígeno A y producen anticuerpos anti -
B, mientras que las personas del grupo B tienen antígeno B y producen
anticuerpos anti - A. Los individuos del grupo A y B tienen antígenos A
y antígenos B pero no producen ningún anticuerpo (ninguna clase de
isoaglutininas). Por este motivo las personas de este grupo se los
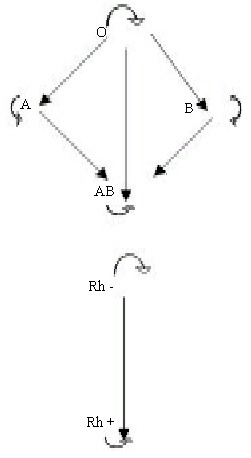
denomina "receptores universales". Figura S - 1.
|
|
|
Fig. - 1: Compatibilidad Sanguínea de los distintos grupos.
Cada grupo puede dar sangre a sí mismo y a los otros grupos en el
sentido de las flechas. |
Los
individuos del grupo O no tienen antígenos en sus eritrocitos, pero si
producen ambas clases de anticuerpos: anti - A y anti - B por lo que se
los conoce a este grupo O como "Donante universal" porque sus ematíes no
son reconocidos por ninguna de las aglutininas ABO. Tabla 2. (8) (2) (1)
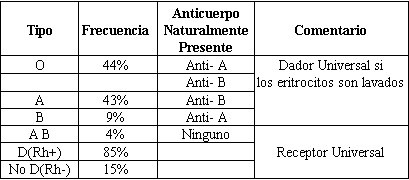
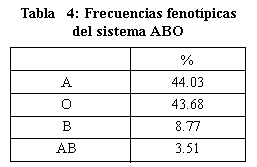
La
frecuencia de los tipos de grupo sanguíneo del sistema ABO son de: grupo
O aproximadamente 44%, grupo A 42.5%, grupo B 8.5% y el grupo A B 4%.
Tabla S - 3. (9). Tabla 4 (10).
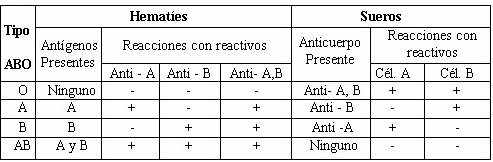
|
Tabla 2: Características y reacciones de los cuatro tipos sanguíneos
ABO |
|
|
|
|
|
Tabla 3: Frecuencia de los tipos de grupos sanguíneos en las
personas de raza blanca (tomado de medicina interna de Kelly segunda
edición) |
|
|
|
|
|
|
|
|
Sistema
RH.
Es el
sistema de mayor importancia transfusional después del ABO. Desde el
punto de vista práctico, se divide a los individuos en Rh (D) -
positivos que representan el 85% de la población mundial y Rh (D) -
negativo que representa el 15% restante. Los genes del sistema Rh se
hallan en el cromosoma 1. Los antígenos del sistema Rh son proteínas
ligadas a los lípidos de la membrana eritrocitaria. Su ausencia ocasiona
la enfermedad del Rh nulo, que cursa además con anemia hemolítica
estomatocítica. Los anticuerpos del sistema Rh y sobre todo los anti-D
tienen gran importancia transfusional, son inmunes y de clase IgG. Se
calcula que el 50% de los individuos pueden desarrollar un anti-D a
partir de la primera transfusión con sangre Rh (D) - positiva. El anti-D
es el antígeno que ha causado mayor número de incompatibilidades en la
EHRN, con la aparición de la inmunoglobulina específica que ha permitido
prevenir la formación de estos anticuerpos, la EHRN ha sido controlada
(10), con el uso de la inmunogamma Anti Rho (anti - D), y en casos en
los cuales la administración positiva de anticuerpos, resuelve el grave
problema de isoinmunización por vía trasplacentaria o durante la
administración de sangre o hemoderivados en mujeres Rho negativas. (3)
Antígenos
de Leucocitos.
Los
principales componentes del sistema inmunitario son los macrófagos y los
linfocitos. Existen antígenos propios de los linfocitos, cuyo interés
radica en la aloinmunización transfusional y en la sensibilidad
fetomaterna. Los propios de los linfocitos son poco importantes y poco
conocidos. Mayor interés tienen los antígenos de los neutrófilos, que
pueden ser exclusivos o compartidos con otros tejidos. Los específicos
de los neutrófilos se indican con la letra N. Los leucocitos
genéticamente independientes se identifican por letras correlativas del
alfabeto, y los alelos se señalan con números arábigos. Se conocen los
antígenos NA1 y NA2, NB1, NC1, ND1, NE1 y HGA3, entre otros. Entre los
antígenos que los neutrófilos comparten con otro tejido destacan los
ABH, Li y Lewis (compartidos con los hematíes), el sistema 5ª y 5b
(común a los linfocitos, plaquetas y algunas células inmaduras) y los
antígenos del sistema HLA, condicionando en gran manera las
transfusiones de plaquetas e incluso las de sangre no desprovista de
leucocitos. Son causas frecuentes, y en algunos casos intensas
reacciones hemolíticas. (10)
Antígenos
de las Plaquetas.
Los
antígenos de las plaquetas pueden ser específicos de ellas, compartidos
con los linfocitos, granulocitos y otros tejidos (sistema HLA),
compartidos con los hematíes (sistema ABO), receptores específicos para
fármacos, criptoantígenos (T oTn) o autoanticuerpo específicos de las
plaquetas (glucoproteína llb/llla, glucoproteína lb). La refractariedad
a las transfusiones de plaquetas se atribuye principalmente a los
antígenos del sistema HLA. (10)
La
importancia de estos sistemas antigénicos leucocitarios y plaquetarios,
se da en el campo de la inmunohematología y en los transplantes de
órganos. Además son responsables de una gran diversidad de trastornos
que van desde las aloinmunisaciones fetomaternas y transfusionales hasta
las citopenias autoinmune. Tabla 5 (5).
Existen
aparte de estos sistemas que hemos estudiado otros sistemas
inmunológicos eritrocitarios que además se presentan en algunas
secreciones del organismo y en el plasma, responsables de muchas
patologias hematológicas y que se estudia a continuación, y que se
detallan en la tabla 1. (5)
Tabla 5
|
Principales trastornos debidos a anticuerpos
antileucocitarios y antiplaquetarios. |
|
Anticuerpos antileucocitarios
Reacciones transfusional febríles
Síndrome
pulmonar agudo postransfusional
Neutropenia neonatal aloinmune
Neutropenias autoinmune
Refractariedad a transfusiones de plaquetas
Anticuerpos antiplaquetarios
Trombopenia neonatal aloinmune
Trombopenias autoinmunes
Púrpura
postransfusional
Refractariedad a las transfusiones de plaquetas
Reacciones transfusionales febríles (¿?) |
Sistema
LEWIS.
Más que un
sistema inmunológico eritrocitario, constituye un sistema de antígenos
solubles presentes en algunas secreciones del organismo y del plasma.
Los anticuerpos de este sistema son generalmente del tipo IgM. Su
representante el anti - Le es capaz de producir reacciones
transfusionales hemolíticas en casos excepcionales, también se le da la
responsabilidad en algunos casos por transplantes renales. (5) (10)
Sistema
Ii.
Considerado
como una colección de antígenos y no como un sistema se interrelaciona
con los sistema ABO y P formando productos intermedios, estos antígenos
están presentes en muchos tejidos y células del organismo. En muchos
casos de enfermedad por crioaglutininas el anticuerpo responsable se
comporta como anticuerpo fijador del complemento. De ahí que la
aparición de anticuerpos anti - i suelen estar relacionadas con
hemopatías malignas y procesos vírales. Por lo general de tipo IgM, sin
embargo en la mononucleosis infecciosa aparecen como IgM. Los anti-I se
aparece en la población sana como autoanticuerpos en títulos bajo. (5)
(10)
Sistema
LUTHERAN.
Los
anticuerpos de este sistema no son muy frecuentes, generalmente inmunes
y encontrados como anticuerpos naturales. Los anti - Lu de tipo IgM, no
ocasionan reacciones hemolíticas postransfusionales, sin embrago los de
tipo IgG se los responsabiliza, como causa de acortamiento de
supervivencia de los hematíes transfundido y de EHRN de moderada
intensidad. (5) (10)
Sistema
P.
Los
anticuerpos del sistema P son irregulares, naturales, los de clase IgM
son hemolíticos y con capacidad de reconocer los hematíes humanos, en
cambio la hemolicina bifásica son de tipo IgG que en individuos Pp
desarrollan el anticuerpo anti - Tj que se ha relacionado con la
presencia de abortos espontáneos en mujeres con este raro fenotipo. (5)
(10)
Sistema
MNS.
Los
anticuerpos anti - M y anti - N reaccionan más intensamente con hematíes
homocigotos que con heterocigotos, se los encuentra en forma natural y
son de tipo IgM. Los de clase IgG pueden causar raramente EHRN. En
pacientes tratados con diálisis se ha encontrado anticuerpos de
especificidad parecidos al anti - N, debido a que la reutilización de
membranas esterilizadas por formaldehído produce una modificación de la
membrana eritrocitaria. (5) (10) Los antígenos Ss se comportan igual que
los MN, son de origen antiinmune se asocian a otros anticuerpos y pueden
provocar reacciones transfusionales EHRN. (10)
Sistema
KELL.
El antígeno
Kell ocupa el segundo lugar en cuanto a su poder inmunológico detrás del
antígeno D. El anti - K puede encontrarse frecuentemente en el suero de
pacientes transfundidos, una de cada 500 personas carecen de antígeno K,
siendo los anticuerpos de tipo IgG los que dan lugar a reacciones
hemolíticas graves y a EHRN. (5)
Sistema
KIDD.
Los
antígenos de este sistema, los anti - Jk, son generalmente inmunes y de
clase IgG, por su fenómeno de dosis hacen difícil su determinación para
detectarlos en el suero de pacientes politransfundidos, ya que
desaparecen los anticuerpos rápidamente al cesar el estímulo antigénico,
se los responsabiliza de reacciones hemolíticas graves y EHRN. (5)
Sistema
DUFFY.
Se ha
descrito que los antígenos anti - Fy actúan como receptores para
Plasmodium vivax, es decir que los individuos con este fenotipo son
resistentes a la infección por el parásito. Los anticuerpos de este
sistema son inmunes y de tipo IgG sin embargo han sido involucrados en
reacciones hemolíticas transfusionales en la EHRN. (5) (10)
Sistema
HLA.
No es un
sistema propiamente leucocitario, ya que los antígenos que los
constituye se encuentran en la membrana de todas las células nucleadas
del organismo. Los eritrocitos maduros carecen de antígenos de este
sistema, sin embargo algunos antígenos de grupos sanguíneos
eritrocitarios pueden considerarse como antígenos HLA, por lo que han
recibido muchas designaciones: antígenos tísulares, antígenos del
complejo mayor de histocompatibilidad, antígenos de transplante y
antígenos de leucocitos humanos.
Los
anticuerpos del sistema HLA son por lo general de origen inmune, de tipo
IgG, con propiedades citotóxicas y leucoaglutinantes, pueden hallarse
anticuerpos linfocitotóxicos en el suero de las primíparas a partir de
las 24 semanas de gestación, aumentado la incidencia según el número de
embarazos o abortos. El desarrollo de estos anticuerpos es debido
probablemente al paso de leucocitos fetales a la circulación materna.
Los anticuerpos HLA tienen una incidencia elevada en pacientes
politransfundidos, dependiendo del número y frecuencia de las
transfusiones recibidas, como de la cantidad de leucocitos presentes en
los productos transfundidos. Los antígenos del sistema HLA tienen
tendencias a estimular la producción de anticuerpos que reaccionan no
sólo con el antígeno causante de la inmunización, sino también con otros
antígenos producidas por el mismo locus (reacciones cruzadas).
El sistema
HLA es importante en los transplantes de órganos y tejidos ya que cumple
un papel esencial en los mecanismos de la respuesta inmune presentado
los antígenos a las células T y, para que estas reconozcan las
diferencias entre lo que es propio y lo que es ajeno. De esta manera la
capacidad de respuesta o tolerancia inmunológica puede estar
condicionada por la capacidad o incapacidad de una constitución
antigénica HLA determinada para presentar un componente extraño. (5)
Selección
de la Sangre del Donante adecuada para la transfusión del receptor.
Clasificación de Donante.
La FDA
establece normas para la recogida, el almacenamiento y el transporte de
sangre y de sus componentes, estas normas también las hacen las
autoridades sanitarias locales o estatales, siguiendo las normas de la
Cruz Roja Americana y la Asociación Americana de Bancos de sangre. La
calificación incluye: una entrevista sanitaria, el análisis de la Hb, la
medición de la temperatura corporal, la frecuencia cardíaca y la presión
arterial.
Las causas
de descalificación incluyen la existencia del antecedente de: hepatitis,
cardiopatía, cáncer (aparte de las formas leves tratables, como los
cánceres cutáneos de pequeño tamaño), asma grave, trastornos de la
coagulación, convulsiones y Sida o pertenencia a uno de los grupos de
riesgo de Sida. Sin embargo existen motivos de descalificación temporal
como son: malaria, exposición a la malaria, exposición a la hepatitis,
estado de gestación, sometidos a cirugía mayor, hipertensión arteria,
anemia y empleo de ciertos fármacos. Algunos de estos criterios protegen
a los donantes potenciales de los posibles efectos adversos de la
donación. En nuestro medio casi todos los donantes no son retribuidos.
(2)
Clasificación del Receptor.
Al realizar
la determinación de los grupos sanguíneos y factor Rh debe etiquetarse
las muestras, con la identificación dada del receptor para luego
determinar el grupo sanguíneo al que corresponden al igual que el factor
Rh, luego debe realizarse prueba de Coombs directo en los glóbulos rojos
del receptor para detectar autosencibilización erotrocitaria. Al mismo
tiempo debe investigarse en el suero la presencia de anticuerpos
irregulares, usando células detectoras de anticuerpos o células en
pantallas. Finalmente sí el paciente ha sido clasificado anteriormente,
debe compararse dicho resultado con los actuales.
Almacenamiento de Sangre.
La donación
estándar de una unidad de sangre consiste en 450 ml, que se recogen en
una bolsa de plástico preservadas y prevenidas su coagulación mediante
soluciones anticoagulantes del tipo: citrato - dextrosa o ACD, citrato -
fosfato - dextrosa o CPD, citrato - fosfato - dextrosa - adenina o CPDA
- 1, o Heparina sódica.
La fecha de
expiración de la sangre completa está determinada por el tiempo de
conservación máximo que permita que el 70% o más de los glóbulos rojos
transfundidos sobrevivan normalmente. Este tiempo se ha estipulado en 21
días para la sangre colectada con ACD o CPD, y en 35 días para la sangre
colectada con CPDA - 1 y de 48 horas con Heparina. Tabla 6. Debido al
riesgo de contaminación bacteriana el tiempo de expiración se reduce a
24 horas si en cualquier momento de su conservación, envase o sistema
plástico es abierto. (2) (6) La unidad de sangre debe ser mantenida bajo
refrigeración continua entre 1 a 6 °C, en ningún momento se le deben
agregar medicamentos o soluciones. (6) Tabla 7. (12)
Clasificación de la Sangre.
Debe
clasificarse según su idoneidad. Ello incluye la tipificación ABO y Rh,
investigación de anticuerpos (Ac), TSS, análisis de los antígenos (Ag)
de superficie y Ac anticore (anti - HBc) de la hepatitis B, valores
normales de ALT (SGPT) y análisis de detección de Ac frente a virus
linfotrópicos de células T humanas (HTLV - I y II) frente a virus
de la hepatitis C y frente al VIH. La etiqueta del recipiente y la
circular de información deben contener los resultados de estos análisis
así como información importante y precauciones a adoptar, que deben ser
consultadas por los profesionales que empleen transfusiones de sangre.
(1) La autotransfusión es el método de transfusión más segura para el
paciente que debería usarse cuando la situación lo permita en pacientes
en los que se ve efectuar cirugía programada, pudiendo recoger del mismo
paciente hasta 3 unidades de sangre en la semana previa a la
intervención, las cuales se utilizarán para la transfusión durante la
cirugía o después de ella. La mayoría de los hospitales y muchos Bancos
de sangre ya disponen de este servicio. Actualmente se ha incrementado
el empleo de sangre autóloga y recuperada, en respuesta al temor del
Sida. (2)
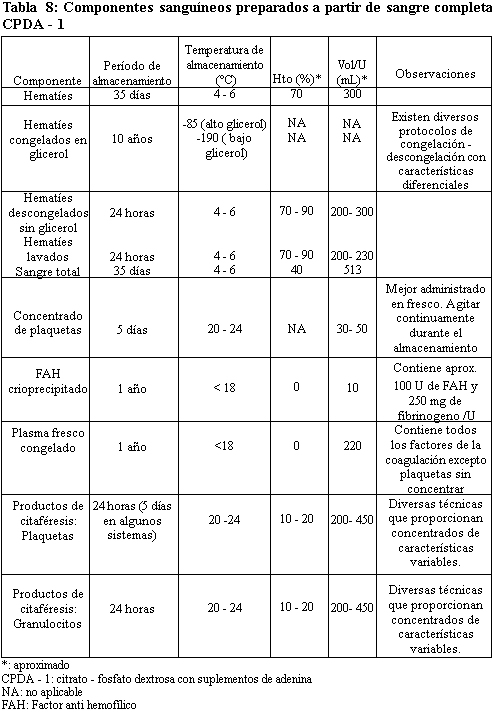
Componentes de la Sangre.
Los
componentes de la sangre pueden separarse, concentrarse y almacenarse
individualmente para su administración específica según las necesidades
del paciente, en la tabla 8 se indican algunas características de la
sangre y de sus componentes tal como se preparan de forma rutinaria en
los Bancos de sangre. (2)
Los
anticoagulantes empleados para proteger los hematíes de la sangre
completa almacenada no son los más óptimos para los restantes
componentes. Los componentes de la sangre disponibles y las indicaciones
para su uso se enumeran en la tabla 9. (11)
Indicaciones para Transfusión de Sangre Entera.
La sangre
entera está indicada en pacientes con un déficit sintomático de la
capacidad de transporte de oxigeno e hipotensión por hipovolemia,
aumentar la presión ouncotica y suministrar factores de coagulación.
(13) (6) Es el producto ideal para los pacientes que han sufrido una
pérdida sanguínea del más del 25% de la volemia total (8) Sin embargo no
es la regla, ya que algunos cirujanos prefieren usar expansores
plasmáticos electrolitos (cristaloides) o coloidales en combinación con
concentrados globulares, lo cual a dado buenos resultados. (6) Sin
embargo la tendencia general es medir la real necesidad y administrar al
paciente lo que es adecuado y no lo tradicional. Las hemorragias menores
(< 10%) se tratan mejor con coloides (albúmina sérica) o cristaloides
(Lactato Ringer, Solución Salina) a las cantidades adecuadas. (11) En
pacientes con insuficiencia cardíaca congestiva o con insuficiencia
renal, puede ser aconsejable el uso de coloides como el
Hidroxietilalmidón en solución al 10 % para poder evitar la sobrecarga
de sodio. (11) Cuando hay que transfundir grandes volúmenes (mas de 5
unidades) de sangre total, es necesario controlar la presión venosa
central (PVC) o la presión de enclavamiento del capilar pulmonar para
evitar una sobrecarga circulatoria. (11) De ahí que en el presente
contenido hagamos conocer las recomendaciones extraídas de los criterios
establecidos por el Hoxworth Blood Center y de los National Institutes
Of Health de los Estados Unidos, recomiendan realizar:
A.-
Determinación del cálculo del volumen sanguíneo. (12)
1. - Volumen
sanguíneo total (VST). Es aproximadamente el 7% del peso corporal
(litros):
a) VST
varones (ml) = 77 x Peso corporal.
b) VST
mujeres (ml) = 67 x Peso corporal.
c) VST
recién nacidos = 80 x Peso corporal.
2. - Volumen
plasmático (VP) = VST - (VST x Hto)
En un
paciente adulto, cada unidad de sangre elevará la hemoglobina (Hb) en 1
g/dl y el hematóclito (Hto) en un 3%. El paciente es pediátrico de 6 a 8
ml de sangre total por Kg de peso elevarán la hemoglobina en 1 g/dl. (5)
(7) Otra indicación para el uso de la sangre completa es la exanguino
transfusión en recién nacidos o en adultos, pero aún en estos casos
puede hacerse con glóbulos rojos suspendidos en plasma fresco congelado.
Una unidad
de sangre entera o total contiene unos 450 ml de sangre y 63 ml de
anticoagulante, con un hematócrito de 36 a 44%. Durante su conservación
sufre diversas alteraciones de interés transfusional que detallamos en
la tabla S - 7. (5) Por lo que es necesario recordar que la sangre
completa conservada contiene glóbulos rojos, y además contiene
leucocitos y plaquetas inactivados, así como productos del metabolismo
celular, proteínas, antígenos, anticuerpos, plasma, alergenos y
anticoagulante acidificado e incremento de potasio y amónio, según haya
sido el tiempo de conservación. (6) Mucho de estos productos, sin
aportar ningún beneficio al paciente, en cambio puede conducir a un
efecto indeseado. Por lo que el tratamiento posterior deberá hacerse
sobre la base de componentes sanguíneos.
|
|
|
|
(7) Mollison
señala que más que indicaciones para transfusiones de sangre completa el
médico cirujano debería conocer las contraindicaciones como son la
insuficiencia cardíaca, enfermedades renales, anemia severa y
transfusión en recién nacidos. (6)
Existen
soluciones cristaloides como el Lactato Ringer que se utilizan para la
reposición inmediata de volumen hasta que se disponga de componentes
sanguíneos. Nota: 3 cc de cristaloide equivale a 1 cc de sangre entera.
(12) También existen soluciones coloidales utilizadas en la expansión
del volumen plasmático tales como:
1. -
Albúmina (5%, 25%) indicados en pacientes con hipovolemia e
hipoproteimenia; para inducir la diurésis (mas furosemida) y para
reducir el edema de la mucosa intestinal y en la intolerancia a la
alimentación en pacientes hipoproteinémicos (controvertido).
2.- Fracción
proteica purificada (plasmanate).- contiene un 83% de albúmina y un 17%
de globulinas. Las indicaciones son las misma que para la albúmina.
3.- Coloides
artificiales o Hetastarch contiene un 6% de Hetastarch en solución
salina, produce una expansión del volumen plasmático, similar a la que
produce la albúmina al 5%, pero con un efecto disminuido al cabo de 24 a
36 horas. Contraindicado en procesos hemorrágicos e insuficiencia
cardíaca congestiva. (12)
Conceptuación de Sangre Fresca.
La mayoría
de médicos especialistas, muchas veces denominan sangre fresca a aquella
en la que de acuerdo a su conservación o edad determinada del paquete de
sangre creen que pierde los niveles de factores de coagulación,
plaquetas, pero estas como indicaciones hoy se conocen que no están
justificadas. El Dr. Herbert A. Perkins, del Banco de sangre Irwing
Memorial de San Francisco - California define como sangre fresca
"aquella sangre que no ha llegado a su límite de expiración, según lo
establecen los estándares y regulaciones gubernamentales". (6) El
ejemplo común de usar sangre fresca, surge cuando un paciente que ha
presentado sangrado en forma aguda y que además ha sido transfundido
masiva-mente persistiendo el sangramiento. El médico piensa que la
persistencia de la anemia aguda, reducción de la volemia,
Trombocitopenia y déficit de factores de coagulación es producto de la
masiva transfusión de sangre de Banco en las que están reducidas los
elementos sanguíneos. Lo correcto es que el médico realice un plan
diagnóstico inmediato, que oriente sobre la terapia transfusional que
deberá emplear, por ejemplo si el paciente tiene una Trombocitopenia
dilucional por sangre conservada que recibió, se beneficiará más pronto
si recibe concentrados plaquetarios. (6)
Indicaciones para Transfusiones de Glóbulos Rojos Concentrados.
Se obtiene
eliminando unos 250 ml de plasma de las unidades de sangre total,
mediante centrifugación. El período máximo de conservación, depende de
la solución conservadora empleada según tabla S - 6. (5) Los paquetes o
unidades de glóbulos rojos concentrado (GRC) tienen un hematócrito del
70 al 80%. (7) Es decir que una unidad de concentrados de hematíes
aumentará en un 3% el hematócrito. Su principal indicación es en el
tratamiento de las anemias normovolémicas. Su administración dependerá
del estado clínico y de la enfermedad de base, y no de los valores de
laboratorio. En pacientes con requerimientos frecuentes (talasemias,
insuficiencia renal crónica, enfermedades malignas, etc.) se aconseja
utilizar GRC con poco tiempo de almacenamiento. Los pacientes que
presentan reacciones febriles no hemolíticas, recurrentes o severas
deben recibir GRC leucoreducidos. (7) Los pacientes con anemia crónica
sintomática deben recibir de 2 a 3 unidades de eritrocitos a intervalos
de 2 a 3 semanas. Indicaciones detalla para componentes de eritrocitos
se expresan en la tabla S - 10. (13)
|
Tabla 10: Indicaciones para componentes de eritrocitos. |
|
Sangre
entera
Déficit
sintomático de la capacidad de transporte de oxígeno e hipovolemia
importante
Eritrocitos (células aglomeradas)
Déficit
sintomático de la capacidad de transporte de oxígeno en pacientes
anémicos
Eritrocitos sin leucocitos
Anemia
sintomática, prevención de reacciones transfusionales febriles
recurrentes no hemolíticas.
Eritrocitos Lavados
Anemia
sintomática, prevención de reacciones de urticaria y anafiláxias
graves en pacientes con deficiencia de IgA
Eritrocitos congelados y descongelados
Anemia
sintomática, conservación de un inventario para tipos sanguíneos
raros |
Indicaciones de la Transfusión de Glóbulos Rojos Lavado.
Se conoce
así al concentrado de glóbulos rojos que es lavado en solución salina
fisiológica estéril, produciendose la eliminación completa del plasma, y
eliminando la mayor parte de leucocitos y plaquetas. Sus indicaciones
son muy raras entre las que se señalan: en pacientes con antecedentes de
reacciones alérgicas anafilácticas graves. En los pacientes con
insuficiencias inmunológicas, especialmente agammaglobulinemia de tipo
IgA. Hasta hace poco los glóbulos rojos lavados (GRL) estaban indicados
en pacientes con insuficiencia renal candidatos a transplante para
evitar la sensibilización por antígenos de histocompatibilidad,
actualmente se conocen que los pacientes candidatos a transplantes que
fueron politransfundidos con sangre con leucocitos, se observó mejor
vida que en quienes habían recibido transfusiones con GRL. Se
recomiendan transfundir hasta 3 unidades de glóbulos rojos pobres en
leucocitos en aquellos pacientes que nunca han sido transfundidos, pero
de requerir mayor número de transfusiones las siguientes deben hacerse
con GRL. (6) (12) (13)
Indicaciones de la Transfusión de Hematíes Congelados.
Los hematíes
congelados no está disponible en nuestro país, sin embargo es importante
conocer su indicación. Los hematíes si bien es cierto se les ha retirado
el plasma, sin embargo este ha sido sustituido por glicerol al 40% y
preservando los paquetes de transfusión de hematíes congelados a -80° C,
o también se utiliza glicerol al 18% pero congelándolos con nitrógeno
líquido a -196° C.
En ambos
métodos el periodo de conservación es de 3 años, sin embargo muchos
autores demuestran que conservaron los hematíes hasta 10 años. Cuando se
requiera de estos paquetes debe eliminarse el glicerol, con lavados de
soluciones electrolíticas en diferentes concentraciones (6). La única
indicación actual para este tipo de transfusión, es la conservación de
unidades de fenotipo muy infrecuente, o de unidades destinadas a la
autotransfusión de individuos con aloinmunizaciones complejas o
reactivas contra antígenos de alta frecuencia. Facilita la remoción de
sustancias vasoactivas (angiotensina, serotonina, bradiquinina) y de
proteínas plasmáticas (IgA, IgG, IgM) (5) (6).
Indicaciones de Hematíes Pobres en Leucocitos.
La sangre
total o concentrada de hematíes, contiene de 1 a 3 x 109 leucocitos, que
puede desencadenar fenómenos de aloinmunización y reacciones febriles no
hemolíticas. Mediante filtros de leucoadhesión de muy elevada eficacia,
se eliminan más del 99% de leucocitos de las unidades de sangre
extraídas recientemente, pero son de alto costo. También se separan los
leucocitos por centrifugación en frío, seguida de transfusión a través
de filtros micro agregados que eliminan el 60% de los leucocitos, ambos
métodos evitan reacciones transfusionales mediadas por leucoaglutininas.
La principal
indicación de los hematíes pobres de leucocitos, es la prevención de las
reacciones transfusionales febriles no hemolíticas. Se dice que los
filtros de leucoadhesión previenen la transmisión transfusional de
Citomegalovirus (5).
Indicaciones de la Transfusión de Plasma.
Siendo el
plasma la porción líquida de la sangre, se la obtiene a partir de
unidades de sangre completa o mediante el proceso de plasmaféresis (6).
Este componente proporciona factores de coagulación, albúmina y
globulinas, sin embargo el avance tecnológico ha hecho que el plasma se
obtenga a parte de la albúmina, fracciones de proteínas plasmáticas,
gammaglobulina y concentrados de los factores de coagulación I
(fibrinógeno), VIII (factor anti hemofílico) y complejo protrombínico
(factores II, VII, IX y X) (6). De acuerdo a su conservación, existen
dos tipos de plasma: plasma de banco (PB) y plasma fresco congelado
(PFC). El PFC proporciona todos los factores de coagulación, lábiles y
estables en un solo preparado. No contiene plaquetas y la concentración
de fibrinógeno es baja (11). Los paquetes de PFC se mantienen a -120° C
para conservar la actividad de todos los factores de coagulación y de la
albúmina por 12 meses (6). La principal indicación del PFC, es
utilizarla en todas las coagulopatías con deficiencia de factores
lábiles de la coagulación como son, en la insuficiencia hepática, CID,
coagulopatías dilucionales y deficiencias congénitas de los factores.
También es utilizable para los sangramientos postquirúrgicos
(hipovolemia), asociado a deficiencia de factores de coagulación no
determinados, en sangramientos secundarios a terapia con
anticoagulantes. Es utilizable en la púrpura trombocitopénica trombótica
y en la hemofilia A (sin embargo para esta es necesario usar concentrado
de factor VIII (6) (11). Ningún tipo de plasma deberá ser utilizado como
expansor o como aporte nutricional (11), sin embargo se usa
frecuentemente el PFC en cirugía general para aportar oligoelementos en
vez de una unidad de plasma simple (11).
Indicaciones de la Transfusión de Crioprecipitado.
Es un
concentrado preparado a partir del plasma fresco congelado, luego de
descongelar y centrifugar a 4° C se recoge una pequeña cantidad de 10 a
15 ml el mismo que se congela a -18° C, y conservándose por 12 meses.
Para su uso debe descongelarse a 37° C y administrado dentro de las 6
horas siguientes. No se debe recongelar (6). Cada bolsa de
crioprecipitado es de 10 a 15 ml que contiene de 80 a 100 unidades de
factor VIII, 250 mg de fibrinógeno, 30% de factor XIII y de 40 a 70% de
factor Von Willebrand (6). Sus indicaciones son la hemofilia A (1 U I de
factor VIII/ kg de peso elevará el nivel preexistente en un 2%), se usa
en la enfermedad de Von Willebrand y en la deficiencia de
fibrinógeno. Se puede requerir grandes volúmenes de crioprecipitados
para controlar la hemorragia en la hemofilia grave o para permitir la
cirugía electiva en el paciente con hemofilia. El riesgo de hepatitis
por el crioprecipitado es muy bajo, también se usan en gran cantidad
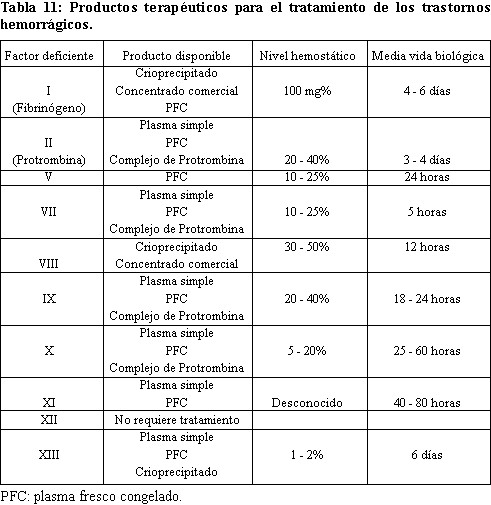
para tratar pacientes con CID conocida (11). Es importante conocer los
valores normales, el valor hemostático y la vida media biológica de cada
uno de los factores para tratar adecuadamente la deficiencia que
presenta el paciente, véase tabla 11.
|
|
|
|
Indicaciones de Fibrinógeno.
Para evitar
el alto riesgo de hepatitis sérica, que trae consigo el uso del
fibrinógeno humano leofilizado, se ha dejado de usar este componente sin
embargo se sigue usando en casos extremadamente raros de
hipofibrinogenemia a afibrinogenemia congénita. El riesgo de hepatitis
con estos concentrados, que se presentan en forma de polvo leofilizado,
es del orden del 15 al 30%.
Indicaciones de las Transfusiones de Concentrado Plaquetario (PLQ).
Pueden
obtenerse de dadores múltiples o de dador único, en este caso mediante
aféresis. Se los utilizan en trombocitopenias intensas con recuentos
plaquetarios menores a 10000/uL, o en hemorragias relacionadas con
trombocitopenias menos intensa. Los concentrado de donantes único están
indicados en pacientes inmuno refractarios y en aquellos que tienen la
posibilidad de recibir transplante de médula ósea. Un concentrado de
plaquetas frescas transfundido en un individuo produce una elevación de
5000 a 10000 en el recuento plaquetario. La dosis usual es de 6 a 10
unidades para un adulto de 70 kg. En pacientes pediá-tricos es de 1
unidad por cada 10 kg de peso. El aumento de plaquetas dependerá de: 1)
el recuento previo de plaquetas y 2) por el estado clínico del paciente.
Su utilidad se recomienda con mucho cuidado ya que muchas veces no es
efectiva en pacientes con CID, sepsis, sangrado activo, esplenomegalia,
portadores de auto o aloanticuerpos antiplaquetarios y en aquellos que
estén recibiendo quimioterapia (2) (7). En la tabla 12 (5) se dan las
indicaciones de la transfusión de plaquetas.
Tabla 12: Indicaciones de la transfusión de plaquetas.
|
Terapéuticas
Detener
hemorragias secundarias a trombocitopenia o trombocitopatías,
independientemente de la causa de estas.
Profilácticas
Prevenir
la aparición de hemorragias espontáneas en pacientes con
trombocitopenia extrema.
-
Trombopenias centrales de duración limitada
-
Rendimientos transfusionales adecuados. |
Indicaciones de las Transfusiones de Leucocitos.
Se obtienen
mediante la leucoféresis de un solo donante y contiene como mínimo 1.0 x
1010 neutrófilos. La eficacia clínica de este tipo de transfusiones es
dudosa ya que implica evaluar el beneficio que ellas añaden a la
terapéutica antibiótica junto a la cual se emplea, el cual resulta
progresivamente menor a medida que van introduciéndose antibióticos más
eficaces. Es usual administrar corticosteroides a los donantes, con la
finalidad de aumentar el número de granulocitos circulantes (5). Su
indicación es para pacientes neutropénicos infectados, siempre que la
antibióticoterapia haya fallado. Su indicación en neonatos, está
aceptada, estén sépticos o no. En el caso que fuera necesario, se
realizará diariamente hasta la recuperación del paciente. Hoy en día,
esta práctica está fuera de uso por ser cuestionada, ya que se promulga
la utilización de factores de estimulación de médula ósea.
Transfusión Autologa.
Llamada
también autotransfusión, ya que se obtiene la unidad de sangre
previamente a actos quirúrgicos, con la finalidad de usar durante la
cirugía la transfusión de sangre propia del individuo de ahí que la
transfusión autóloga desciende los riesgos de transmisión de
enfermedades y reacciones transfusionales inmunológicas.
Transfusiones de Hemoderivados Plasmáticos.
Entre estos
tenemos la albúmina que viene en concentraciones de 5 y 25% es utilizada
en pacientes hipoproteinémicos. Tenemos también factores de coagulación
como el concentrado de factor VIII, que se utiliza en el tratamiento de
la hemofilia A para aumentar los valores del factor a niveles
hemostáticos, así como también tenemos complejos protrombínicos que
aportan factores II, VII, IX y X más antitrombina III y proteína C.
Están indicadas en el tratamiento de las hemorragias y profilaxis de
sangrados por deficiencia de los distintos factores del complejo. Las
inmunoglobulinas es otro de los hemoderivados, contiene
predominantemente IgG (16.5 g/dl), su vida media es de 22 días y se usan
para profilaxis de ciertas enfermedades en individuos susceptibles y
como terapéutica de reemplazo en deficiencias congénitas de
inmunoglobulinas (7) (4).
Pruebas
Inmunohematológicas previas a la Transfusión.
Como ya se
indicó anteriormente sobre las reacciones transfusionales hemolíticas,
febriles, anafiláxia y de incompatibilidad debe clasificarse en primer
lugar a los donantes y receptores en función de sus tipos ABO, teniendo
como norma, que la sangre seleccionada para la transfusión debe ser del
mismo grupo ABO que la del receptor. Salvo el caso en situaciones
urgentes, pueden utilizarse unidades del grupo O para pacientes con
grupos sanguíneos y hematíes A o B en receptores AB (No ambos
conjuntamente). Particularmente debe realizarse también la tipificación
Rh. Si la muestra de sangre de una mujer gestante es Rh negativo, debe
informarse al gineco-obstetra, para que se realice un estudio de
tipificación Rh del producto fetal. Además debe realizarse pruebas de
compatibilidad conocidas como pruebas cruzadas, con el fin de investigar
anticuerpos en los donantes y en los receptores. De tal manera que la
prueba cruzada es con el fin de investigar tres objetivos:
1) Confirmar
que existe compatibilidad ABO entre el receptor y el donante.
2) Detectar
algún anticuerpo en el suero del paciente
que
no se pudo demostrar en la prueba de detección.
3) Cumplir
con las regulaciones que establecen las
organizaciones de Bancos de sangre y las
legislaciones de cada país.
La prueba
cruzada se realiza de dos maneras:
a) Prueba
cruzada mayor, consiste en mezclar el suero del paciente con los
glóbulos rojos del donante.
b) Prueba
cruzada menor, consiste en mezclar el plasma del donante con los
glóbulos rojos del receptor.
Técnica
de la Transfusión.
Es
conveniente usar un catéter de calibre 18 o mayor. Debe emplearse
equipos de transfusión con filtros. Ninguna solución, aparte de la
solución salina al 0.9%, debe dejarse entrar en la bolsa de sangre o en
los mismos tubos de la sangre, dado que muchas soluciones pueden
provocar efectos perjudiciales como la aglutinación o disminución de la
supervivencia de los hematíes. La transfusión de una unidad de sangre no
debe durar más de 2 horas. Debe observarse al paciente durante los
primeros 15 minutos para observar si se producen reacciones graves a la
transfusión. El paciente debe estar en ambiente cálido, y las
transfusiones deberían realizarse durante la mañana y tarde y no en la
noche (salvo casos de urgencia). De aparecer alguna reacción indeseable
se debe interrumpir la transfusión y notificar el hecho al Banco de
sangre para que se inicie una nueva investigación (2).
Complicaciones de la Transfusión.
Las
complicaciones producidas por la transfusión se clasifican en:
I.-
Reacciones inmediatas a la transfusión.
A.-
Reacciones en las que las transfusiones pueden continuarse.
1)
Reacciones alérgicas: urticarias, prurito.
2)
Reacciones febriles.
3)
Sobrecargas circulatorias.
B.-
Reacciones en las que las transfusiones no
pueden continuar (interrumpirse)
1)
Reacciones febriles graves por contaminación bacteriana.
2)
Reacciones hemolíticas a la transfusión.
3)
Reacciones hemolíticas retardadas.
II.-
Reacciones tardías a la transfusión
A)
Isosensibilización.
B)
Transmisión de enfermedades.
1)
Hepatitis sérica.
2)
Brucelosis.
3)
Malaria.
4)
Enfermedad por inclusión de citomegalovirus.
III.-
Complicación de la transfusión masiva de sangre.
1)
Hipotermia.
2)
Intoxicación por citrato.
3)
Hiperpotasemia.
4)
Acidosis.
5)
Hiperamoniemia.
6)
Defectos de coagulación.
7)
Síndrome pulmonar postransfusión y otras complicaciones pulmonares.
Las
reacciones a la transfusión, tienen una incidencia global del 5%. Se han
reportado reacciones alérgicas, por transferencias pasivas de antígenos
del donante al receptor con una incidencia del 1.6/1000 pacientes. Su
presentación está dada por rubor, urticaria, prurito, para lo cual se
debe tratar con 50 mg de difenhidramina por vía oral o intravenosa.
Reacciones graves se pueden tratar con adrenalina y corticosteroides. En
futuras transfusiones deberán utilizarse concentrados de hematíes
lavados. Las reacciones febriles debidas a anticuerpos frente a los
antígenos leucocitarios del donante, se presentan con una incidencia de
3/1000 pacientes, acompañados de fiebre, escalofríos, cefalea, deben ser
tratados con antipiréticos como el acetaminofen. Los pacientes con más
de 3 episodios de reacción febril postransfusional deben recibir
concentrados de hematíes lavados o congelados. En los pacientes con
sobre carga circulatoria, existen antecedentes de patología cardíaca o
renal preexistente, por lo que en estos tipos de pacientes la
transfusión debe durar entre 4 a 3 horas, al mismo tiempo que se
administran diuréticos por vías intravenosas entre las transfusiones
(12). En las contaminaciones bacterianas posteriores a transfusiones
existe una incidencia del 0,1% de unidades de sangre que están
contaminadas con microorganismos de crecimiento en frío, se debe
interrumpir la transfusión y administrar líquidos por vía intravenosa,
antibiótico, corticosteroides, agentes inotrópicos más transfusiones de
sangre no contaminada.
La
transfusión masiva, producto de la administración rápida de cantidades
elevadas de sangre conservada en Bancos con CPD tiene probabilidades de
provocar complicaciones por la hipoperfusión, daño tisular, así como
lesiones de "almacenamiento" de la sangre almacenada. Así tenemos: la
hipotermia es la más frecuente, con efectos sobre la coagulación, la
función plaquetaria y el equilibrio ácido básico. Se recomienda la
prevención, mediante la utilización de dispositivos que calienten la
sangre, o sistemas de infusión rápida diseñadas para administrar grandes
volúmenes de sangre, es necesario también elevar la temperatura
ambiental así como también calentar las soluciones intravenosas.
La toxicidad
del citrato conlleva a la hipocalcemia, y luego conducir a una
disfunción cardíaca en pacientes con cardiopatía preexistente. De ahí
que por cada 3 a 5 unidades de sangre total transfundida, o por cada 5 a
8 unidades de concentrado de hematíes se debe administrar 1 g de cloruro
cálcico o 4 g de gluconato de calcio.
La
hipercaliemia, se produce por elevado contenido de potasio extracelular
de la sangre almacenada, que conlleva a la aparición de arritmias
cardíacas, sobre todo en pacientes con insuficiencia renal. La Acidosis
es otra complicación de la transfusión masiva, debida a la hipoperfusión
y al bajo Ph de la sangre almacenada. La hiperamonemia aparecen por la
acumulación de amónio en la sangre almacenada, pudiendo conllevar a
encefalopatía hepática en pacientes con insuficiencia hepática.
Finalmente las coagulopatías aparecen como complicaciones de las
transfusiones masivas debidas al consumo y dilución de los factores de
la coagulación y de las plaquetas, así como los efectos de la hipotermia
(4) (7) (11) (12).
Bibliografía
1. Litter M. Tratado de Farmacología . 5ta Edición, Editorial el Ateneo
.1977.
2. Pocker R. The Merck Manual of Diagnosis and Therapy - Fifteenth
Edition, 1987.
3. Aguayo J. Texto de la cátedra de cirugía de la Universidad de
Guayaquil. 1era Edición, año 1998.
4. Manual de terapéutica médica Washington University 2da Edición,
Interamericana, 1994.
5. Sanz J. Hematología clínica . 3ra edición, Doyma Libros S.A. 1994.
6. Ruiz E. Manual de hemoterapia . Sociedad Ecuatoriana de Patología.
7. Bujas M, Núñez F. Terapia intensiva 2da Edición. Sociedad Argentina
de Terapia Intensiva, 1995.
8. Dzieckowski J, Anderson K. Principios de medicina interna de Harrison,
Editorial Mc Graw Hill, 1998.
9. Deisseroth A, Wallesrsteil R. Medicina Interna de Kelley. 2da
Edición, Editorial Panamericana, 1992.
10. Vega M. Medicina Interna de Farrera Rozman vol. 2, 13ra Edición,
1995.
11. BaKer R. Manual de Terapéutica Médica por Condon, 1984.
12. Hiyama D y Colaboradores. Manual de cirugía The Mont Reid Hospital
2da Edición. 1993.
13. Menitowe J. Tratado de medicina interna por Cecil, Editorial
Interamericana. 1994.
|