Anastomosis
y Suturas Gastrointestinales
|
|
|
Dr. Francisco Parodi Z. |
|
Dr. Mois�s Idrovo Hugo |
1.- Introducci�n
1-1.-Principios de Reparaci�n Tisular.-
Uno
de los atributos m�s importantes del ser vivo es su capacidad para auto-repararse. Esto
implica la capacidad de monitorizar su estructura y reconocer las desviaciones que pueden
ocurrir a esa norma. Toda autoreparaci�n tisular va acompa�ada de adaptaciones
fisiol�gicas del organismo en un esfuerzo para mantener su integridad.
Com�nmente se considera la reparaci�n
tisular en t�rminos estrictamente morfol�gicos sin embargo la naturaleza a dado la pauta
que toda regeneraci�n o reparaci�n debe ser funcional. No solamente es la
regeneraci�n o reparaci�n un crecimiento morfol�gico sino tambi�n una restauraci�n
funcional.
Existen muchas v�as por las cuales los
organismos vivos se autoreparan, dependiendo cada uno de ellos de su propia organizaci�n
y del nivel del defecto. Sin embargo, cada una de las formas de reparaci�n est�
orientada a ser la mejor manera de recobrar la funci�n.
a) Turnover.- Es tambi�n llamada
regeneraci�n fisiol�gica, consiste en un fen�meno a nivel molecular donde virtualmente
todos los componentes son constantemente remplazados de acuerdo a su vida media. Ejemplos
de este tipo de regeneraci�n est�n la piel, las c�lulas de la sangre y los fol�culos
del ovario que mantienen su recambio gracias a la proliferaci�n de las c�lulas desde
centros germinativos que reemplaza de manera similar a todas las c�lulas perdidas.
Existen algunas c�lulas en el hombre como el m�sculo y los nervios que son mitoticamente
estables pero sin embargo ofrecen un sistema de Turnover a nivel estrictamente molecular.
Ya sea que el Turnover se realice en el �mbito molecular, celular o histol�gico, lo
importante es la capacidad de s�ntesis y degradaci�n que es capaz de realizar la c�lula
para mantener el balance, mecanismos que aun no han sido completamente determinados.
b) Compensaci�n.- Est�
�ntimamente relacionado fisiol�gicamente al anterior y pr�cticamente cada �rgano y
tejido de la econom�a es capaz de presentar compensaci�n aunque lo expresen de manera
diferente y cuyos principales mecanismos son la hipertrofia, hiperplasia y atrofia.
B�sicamente, compensaci�n significa que los �rganos y tejidos tienen que ajustar sus
dimensiones para mantener la funci�n en niveles adecuados.
La hiperplasia, como mecanismo
compensatorio es visto claramente en las resecciones hep�ticas, la misma que al reducir
la masa y la funci�n del h�gado lo estimula a presentar una notable actividad mit�tica
para restaurar el tama�o de la masa original. La pregunta clave a este fen�meno es qu�
incita al h�gado a crecer y cuando sabe que ya no tiene que hacerlo porque su masa ha
sido restaurada.
La hipertrofia es una compensaci�n
funcional que observamos cuando se extirpan generalmente �rganos dobles por ejemplo la
compensaci�n renal que sigue a la extirpaci�n de un ri��n, el mismo que se logra
mediante una combinaci�n de hipertrofia e hiperplasia acompa�ado por un inusual aumento
de ADN, ARN y la consecuente s�ntesis de prote�nas. Aunque el ri��n remanente no
alcanza completamente el doble de su masa, que seria una respuesta l�gica a la p�rdida
del 50% de su masa, la capacidad absortiva y secretora es suficiente para mantener los
nitrogenados y electrolitos de la sangre en condiciones normales.
Existen ciertas condiciones en la cual la
atrofia del �rgano es la respuesta para mantener la funci�n bajo condiciones adecuadas
teniendo en cuenta que estrictamente se define a la atrofia como una ausencia de tejido en
crecimiento y no a una degeneraci�n tisular. Un ejemplo caracter�stico es el que se
produce en los hemat�es cuando la tensi�n de oxigeno es superior a la atmosf�rica, al
encontrar el organismo una superpoblaci�n de c�lulas rojas para cumplir la funci�n, se
desacelera la producci�n de hemat�es por la m�dula o sea hasta restaurar el balance. En
este sentido, la anemia consecuente representa una atrofia en el sistema eritropoy�tico
pero en realidad lo que ocurre es que el organismo intenta mantener un equilibrio entre la
oferta de ox�geno y demanda del mismo. La atrofia como una forma diferente es observada
en el m�sculo esquel�tico cuando no existe ejercicio f�sico o en los nervios cuando
estos son cortados, demostrando la relaci�n existente entre morfolog�a y funci�n.
c) Cicatrizaci�n.- Proceso llamado
tambi�n de curaci�n de las heridas. Todos los tejidos del cuerpo excepto los dientes
tienen la capacidad de repararse cuando una injuria los lesiona. Una injuria debe ser
definida como una interrupci�n en la continuidad de los tejidos y la reparaci�n consiste
en restablecer esta continuidad.
La reparaci�n por cicatrizaci�n significa
que c�lulas especiales llamados fibroblastos proliferen, se diferencien y migren para
reparar la injuria. Esta diferenciaci�n celular no significa que el fibroblasto no se
diferencia en ning�n tipo histol�gico especializado.
El tejido epitelial cura primariamente por
migraci�n celular posiblemente porque su estructura es b�sicamente bidimensional pero en
el caso de ciertos tejidos mesod�rmicos donde se conserva una estructura en tres
dimensiones, la reparaci�n toma la forma de agregados de c�lulas que emigran dentro de
la lesi�n tomando la forma de tejido de granulaci�n en caso de la dermis o del callo
�seo en presencia de fractura de los huesos. La cicatrizaci�n por lo tanto es una
reacci�n dise�ada para restablecer la continuidad interrumpida de los tejidos sin que
las c�lulas reparadoras se diferencien totalmente en nuevos elementos similares a la
parte lesionada. Esto b�sicamente es lo que distingue a la reparaci�n llamada
regeneraci�n epim�rfica.
d) Regeneraci�n epim�rfica.- Es el
proceso biol�gico que repara las lesiones remplazando en su totalidad el �rgano
amputado, el mismo que generalmente es un ap�ndice de locomoci�n. Este tipo de
reparaci�n ocurre siempre y cuando exista un remanente del �rgano amputado, si la
totalidad del ap�ndice falta, la regeneraci�n no tiene lugar.
La regeneraci�n epim�rfica es
caracter�stica de ciertas especies inferiores como los invertebrados y alguno que otro
vertebrado. Sin embargo los mam�feros no poseen esa propiedad. Estudios actuales han
concluido que estos aparentemente poseen en forma potencial la capacidad para regenerarse
sino que est�n inhibidas de alguna forma y el d�a que este mecanismo sea descubierto el
mecanismo de regeneraci�n de miembros resolver� uno de los grandes problemas de la
biolog�a.
2.-Anastomosis Intestinales
2.1.- Generalidades.-
Como el contenido del tracto digestivo, es
sumamente infeccioso, al practicar una apertura o secci�n en la pared intestinal, se abre
una de las m�s potentes fuentes de infecci�n en pleno campo quir�rgico, protegido hasta
este momento con gran celo contra los g�rmenes del exterior. El contenido del tubo
digestivo es tanto m�s infeccioso cuanto mayor sea su proximidad al ano, desde ese punto
de vista, el contenido del est�mago es menos infeccioso, y el del recto el m�s
peligroso. Sin embrago cuando existe alg�n grado de obstrucci�n o en el c�ncer, la
cantidad de las bacterias y su virulencia aumenta considerablemente.
El peligro de que este contenido intestinal
se propague debe conjurarse mediante una t�cnica quir�rgica met�dica y segura del
manejo del intestino tratando que la invasi�n de g�rmenes durante la operaci�n se
mantenga en lo posible en los l�mites m�s reducidos, aisl�ndolo cuidadosamente de los
�rganos circundantes por medio de compresas con el objeto de absorber inmediatamente la
m�s peque�a cantidad de contenido intestinal derramado.
"Cortar bien, suturar bien y
todo ir� bien" reza un aforismo quir�rgico siempre en vigencia. La meta de
una sutura gastrointestinal es proporcionar un cierre herm�tico en el intestino o en la
anastomosis con otra v�scera. Para alcanzar estos objetivos la sutura intestinal debe
buscar los siguientes par�metros definidos:
1.- Colocaci�n de suficiente n�meros de
puntos poco separados.
2.- Invertir la mucosa para evitar que
sobresalga por la l�nea de sutura.
3.- Poner frente a frente las superficies
serosas para formar una uni�n s�lida lo m�s r�pido posible.
4.- Cohibir la hemorragia de la pared
intestinal en forma muy precisa.
5.- Aproximar los bordes seccionados de la
mucosa para evitarla estenosis cicatrizal.
6.- Evitar la tensi�n en la l�nea de
sutura.
7.- El cierre o las anastomosis, deben
realizarse siempre en bordes con buena irrigaci�n sangu�nea.
Casi todos los tejidos del tubo digestivo
son similares en sus planos: mucoso; submucoso; muscular y seroso por tal circunstancia,
la sutura deber�a ser en todos los niveles id�ntica. Desde los tiempos de Halsted, se ha
insistido que la submucosa es el elemento m�s s�lido de la pared intestinal en la
confecci�n de una sutura, efectivamente, este plano es una l�mina consistente formado
por abundante tejido conjuntivo muy bien irrigado, a diferencia de la mucosa que es
fr�gil, sin consistencia para la sutura.
La capa muscular es otra de las capas que
presentan resistencia, sin embargo su grosor no es similar en todos el tracto digestivo
por lo que algunos segmentos son f�ciles de suturar y otros m�s dif�ciles. El est�mago
es el �rgano ideal para realizar suturas porque su muscular tiene un considerable espesor
y los puntos hacen buena presa. Sin embargo existen ciertas enfermedades como la gastritis
atrofica y el c�ncer que la torna fina y friable la cual se desgarra al anudar el punto
de sutura.
El duodeno es m�s dif�cil de suturar, su
musculatura es delgada y como se encuentra fijado al retroperitoneo la tensi�n que puede
utilizarse en los puntos, tiende a dilacerar las capas. Por lo tanto las suturas
duodenales son de mucho cuidado.
El intestino delgado de manera similar al
duodeno tiene una muscular muy delgada pero una enorme diferencia es que las anastomosis y
suturas casi nunca quedan tirantes por su movilidad, aqu� puede surgir es el problema de
reducci�n del calibre que pueden producir las suturas. El colon tiene buena resistencia a
la sutura, salvo que est� adelgazado por dilataci�n, sin embargo las suturas deben ser
realizadas con mucho cuidado especialmente porque la resistencia de la muscular por fuera
de las cintillas est� notablemente disminuidas.
Hay dos �rganos que presentan deficiencias
estructurales importantes para ser suturados: el es�fago y el recto retroperitoneal, ya
que carecen de revestimiento seroso lo que impide una buena resistencia en la toma
seromuscular.
En resumen una buena t�cnica es importante
para lograr el �xito en estas suturas, siguiendo estrictamente las siguientes reglas y
principios, referente a: condiciones biol�gicas del paciente, tensi�n en la sutura,
vascularizaci�n de los bordes, calibre de la luz intestinal.
Un concepto quir�rgico importante que
siempre debemos tener presente es que toda sutura realizada bajo tensi�n est� condenada
a fracasar por lo tanto se vuelve imperativo que los bordes a suturar est�n en contacto
sin esfuerzo de atracci�n. La tensi�n observada inicialmente aunque peque�a, con el
transcurso de los d�as, bajo la influencia del tono intestinal, del peristaltismo, del
peso visceral hace que la sutura falle inevitablemente.
Por otro lado suturar elementos
desvascularizados es ir irremediablemente a una dehiscencia de la anastomosis o sutura,
fen�meno observado entre el tercero al quinto d�a del postoperatorio. Es importante para
evitar esta complicaci�n realizar una correcta liberaci�n del meso que en caso de
duodeno no debe superar el 0,5 cm y en el intestino delgado y colon en no m�s de un
cent�metro. El est�mago en estas situaciones es privilegiado ya que est�
excepcionalmente irrigado. La luz intestinal debe conservarse lo m�s amplia posible para
lo cual la sutura no debe ser oclusiva. Hay dos factores que favorecen netamente la
estenosis: el empleo de la sutura continua y los m�ltiples planos.
Las suturas intestinales son de dos tipos
fundamentales: interrumpidas en las que cada punto se realiza por separado y continuas,
donde toda la l�nea de sutura se realiza con un solo hilo. Ambas pueden ser realizadas
con toma total de la pared, seromuscular y extramucoso. Estas dos
�ltimas son tambi�n llamadas de tipo invaginante porque tratan de enterrar la
mucosa y obtener contacto s�lo del plano seromuscular. Pasaremos ahora a describir las
suturas m�s importantes que pueden realizarse en cualquier parte del tubo
gastrontestinal, ya sea para cerrar un orificio existente, ocluir un segmento intestinal
terminal y establecer entre dos segmentos una conexi�n que permita el libre tr�nsito del
contenido intestinal.
2.2.- Constituci�n de los Planos
Intestinales.- El tracto intestinal esta dividido anat�micamente en cuatro elementos:
la mucosa, que es un plano consistente de epitelio con su activa membrana basal, l�mina
propia y muscularis mucosae; un poco mas hacia adentro encontramos a la submucosa el cual
es una banda de tejido conectivo que contiene vasos sangu�neos y linf�ticos; La muscular
propia; y el peritoneo que lo cubre hacia el interior de la cavidad abdominal y es una
extensi�n del peritoneo. Esta forma de distribuci�n de los diferentes planos es
encontrada en todo el tracto gastrointestinal excepto la parte proximal del es�fago, el
recto y parte del duodeno que no tienen cubierta serosa por ser extraperitoneales.
Mucosa.- La mucosa es un plano
conformado especialmente por c�lulas epiteliales que forman gl�ndulas, criptas,
vellosidades etc. dependiendo de la regi�n del tubo gastrointestinal que se estudia. Sus
c�lulas son en la mayor�a constituyente de un epitelio columnar excepto en el es�fago
que es escamoso y estratificado. El plano epitelial es continuo y uno de los m�s
din�micos de la econom�a por lo que se ha ganado el nombre de "epitelio de
renovaci�n1" ya que es capaz de colocar c�lulas completamente
diferenciadas desde su zona de proliferaci�n la membrana basal a la superficie luminal en
un tiempo de apenas 3 a 8 d�as.
La membrana basal del intestino no
ha sido estudiada en forma intensa pero se asume que es similar al epitelio de otros
tejidos2. La formaci�n estructural b�sica de ella es una l�mina densa
compuesta por colagena tipo IV arregladas de manera reticular3, cuya
constituci�n qu�mica es la heparan-sulfato proteoglycan el cual le proporciona un escudo
cationico contra el escape de macromol�culas anionicas4. Esta membrana es
producida y depositada por las c�lulas epiteliales de la mucosa.
La l�mina propia es una capa de
tejido conectivo que sostiene al epitelio y esta formada por colagena tipo I, III y V5
y elastina con una red de capilares y linf�ticos cuya funci�n es facilitar la absorci�n
y secreci�n. Recientemente en la l�mina propia de las vellosidades del intestino delgado
han sido descritas c�lulas mesenquimatosas que incluyen miofibroblastos, fibroblastos y
c�lulas de m�sculo liso6, 7, adem�s existen linfocitos, macr�fagos,
c�lulas plasm�ticas y eosin�filos en forma normal que juegan un importante papel en la
funci�n inmune del intestino8.
La muscularis mucosae, es una fina l�mina
de m�sculo liso conformada por 2 a 5 c�lulas que separan la l�mina propia de la
submucosa. Su precisa funci�n no ha sido determinada pero se asume que contribuye
efectivamente a la motilidad del intestino y a mantener la mucosa plegada para aumentar la
superficie de absorci�n/secreci�n.
Submucosa.- Este plano esta formado
predominantemente de col�gena con alguna cantidad de elastina y numerosos vasos
sangu�neos su funci�n es conectar los dos planos de m�sculo liso. La mayor cantidad de
col�gena de la pared intestinal esta en la submucosa cuyo an�lisis bioqu�mico ha
presentado una constituci�n del 68% del tipo I; 20% tipo III y 12% col�gena del tipo V9.
Es importante conocer que este tipo de col�gena ha sido encontrado tambi�n en la aorta
humana10. Estudios han demostrado que son las c�lulas musculares lisas las que
producen esta col�gena en comparaci�n con los fibroblastos situados en la piel11.
Comparado con otros tejidos del cuerpo, la
submucosa es relativamente uno de los m�s ricos conteniendo col�gena tipo V, por ejemplo
la piel12 solo tiene un 2% y las encias13 1%. Su rol en la
estructura y funci�n a�n no ha sido claramente delineado pero aparece uniendo
�ntimamente a la mucosa con la capa muscular propia.
Muscular Propia.- Este plano
consiste en una densa formaci�n de c�lulas musculares lisas rodeadas por una fina capa
de fibrillas de protocolagena de 30 a 35 mm de di�metro. Estas fibrillas se unen luego
para formar las fibras de col�gena constituyendo entre las c�lulas musculares unos
verdaderos tabiques. El an�lisis bioqu�mico de la col�gena humana de la capa muscular
propia, revela que es predominante los tipos I y III, con peque�as cantidades del tipo V14.
La cantidad de fibras de col�gena en el plano muscular liso es tres veces m�s abundante
que en el m�sculo esquel�tico estriado lo que hace pensar que su funci�n es similar a
la de un tend�n que sirve para trasmitir fuerzas longitudinales entre los grupos
musculares lisos del intestino. Experimentalmente ha podido demostrarse que la hipertrofia
intestinal asociada a una obstrucci�n se produce por aumento del col�geno contenido
especialmente en el plano muscular de la pared intestinal16.
El plano muscular no mantiene una
continuidad sino que presenta grandes espacios que son ocupados por nervios, capilares
sangu�neos y un tipo de c�lulas intersticiales que son reconocidas en forma
controversial como neuronas simp�ticas modificadas, c�lulas inmaduras de m�sculo liso o
fibroblastos modificados15.
Serosa.- Es la t�nica m�s externa
y est� formada por tejido conectivo areolar relativamente denso y el�stico. A menudo se
mezcla con el tejido conectivo de las estructuras vecinas y recibe el nombre de
adventicia, pero en otras regiones est� cubierta por el peritoneo (por una sola capa de
c�lulas mesoteliales planas) y entonces se llama serosa. Contiene vasos sangu�neos y
linf�ticos que a trav�s de ella pasan hacia otras capas.
2.3 - Reparaci�n en el Tracto
Gastrointestinal
La fisiopatolog�a de la reparaci�n
tisular en el tracto gastrointestinal ha sido muy poco estudiada, sin embargo los mayores
avances se han logrado sobre los procesos de reparaci�n del epitelio g�strico en
respuesta a la injuria aguda. Los cient�ficos han tomado los datos de laboratorio,
cl�nicos y patol�gicos derivado de la respuesta reparadora que realiza �l estomago
contra la injuria acidop�ptica para formarse un marco conceptual en el cual se comprendan
tambi�n algunos de los principios de la reparaci�n del intestino.
La reparaci�n de las lesiones g�stricas y
duodenales tienen dos fases muy marcadas. Uno de ellos es cuando la lesi�n se produce en
�reas donde la l�mina basal permanece intacta (erosiones). En este caso, las
c�lulas que permanecen intactas alrededor de la lesi�n emigran dentro del defecto
durante las primeras 1 o 2 horas que siguen a la lesi�n repar�ndola completamente. Hay
que tener presente que en este tipo de lesi�n no se produce ning�n tipo de
proliferaci�n celular ni inflamaci�n que envuelva al proceso. Estudios recientes han
sugerido que la contracci�n de las vellosidades a partir de las c�lulas musculares lisas
contenidas en la l�mina propia juega un papel preponderante en la reconstituci�n
epitelial de la lesi�n.
Si la injuria penetra a trav�s de la
l�mina basal dentro de la l�mina propia los vasos contenidos en ella se rompen y
la inflamaci�n se vuelve un mecanismo de protecci�n. En estos casos, el epitelio demora
mas para curarse y lo realiza por un proceso de mitosis y proliferaci�n celular. Cuando
la lesi�n es mas profunda, penetrando dentro de la submucosa y muscular propia, la
reparaci�n siempre muestra un grado de reparaci�n fibr�tica. El grado de fibrosis de
estas lesiones y su reversi�n depende de la cronicidad de la lesi�n y su profundidad.
Las erosiones curan pronto y producen fibrosis, las �lceras agudas cuando son de corta
duraci�n producen una cicatrizaci�n por fibrosis leve, la misma que puede reabsorverse y
no mostrar cicatriz. Las lesiones cr�nicas cicatrizan en cambio por extensas fibrosis
produciendo gran distorsi�n anat�mica de los "�rganos como la estenosis esof�gica
que se observa en la enfermedad de Barret, �l est�mago o duodeno en reloj de arena en la
�lcera p�ptica cr�nica circunferencial.
Microsc�picamente, las lesiones p�pticas
cr�nicas en los estadios tempranos aparecen con intensa fibrosis de la submucosa e
hipertrofia de la muscular propia, m�s tarde si la irritaci�n continua este plano se ve
en su totalidad reemplazado por tejido fibr�tico. Utilizando estas observaciones como
modelos para extrapolar los resultados se ha concluido: a) La calidad de la respuesta
reparadora del intestino a la injuria est� determinada por dos factores 1) La cronicidad
de la injuria y 2) la profundidad de ella. Las lesiones confinadas a la mucosa curan con
un completo retorno normal tanto morfol�gico como funcional por un proceso de
regeneraci�n y reposici�n sin que exista formaci�n de tejido caracter�stico de la
fibrosis. Las injurias que involucra los planos profundos de la pared intestinal cura
siempre depositando en la lesi�n tejido de fibrosis, pero si la lesi�n no es cr�nica la
fibrosis puede ser revertida.
3.-Cicatrizaci�n de las Anastomosis
Intestinales.-
La mayor complicaci�n que aparece en las
anastomosis es la p�rdida por las suturas y las dehiscencias especialmente del colon,
recto y es�fago, las mismas que est�n asociadas a una alta morbilidad y mortalidad17,
18. En la literatura m�dica existen muchas variaciones respecto a la incidencia con
la que ocurre la falla en las anastomosis. Las complicaciones que aparecen despu�s de
anastomosis del colon17, 19 se ha reportado entre el 2 y el 18%. Sin embrago si
se realizan estudios controlados guiados por enemas y examen radiol�gico de las
anastomosis en forma temprana, se observan perdidas por la l�nea de sutura20, 21
entre el 40 y 51%. En el es�fago la frecuencia de fugas anastom�tica se encuentra entre
el 5 y 21% el mismo que esta asociado a una mortalidad mucho mas alta que las fugas del
colon22,23 mientras que las complicaciones de las anastomosis del intestino
delgado24, 25 tienen una incidencia mucho menor que la del colon y es�fago
report�ndose porcentajes entre el 1 y 4%.
Sin embargo, a pesar de las diferencias que
existen entre los protocolos de investigaci�n, la incidencia exacta de las complicaciones
que se observan en las anastomosis gastrointestinales es desconocida y posiblemente
dependa de la regi�n donde se realiza la anastomosis, sin embargo la frecuencia es alta y
generalmente sus consecuencias son muy serias por lo cual en los �ltimos a�os la
cicatrizaci�n gastrointestinal ha recibido mucha atenci�n por parte de los cirujanos e
investigadores, llegando a la conclusi�n que toda complicaci�n en las anastomosis como
dehiscencia, fuga anastom�tica y estrictutura temprana o tard�a depende de:
a) Defectos en las suturas;
b) alteraciones tisulares del borde
anastom�tico;
c) anomal�as en la cuencia de
cicatrizaci�n.
Como se menciono anteriormente, la fuerza
mec�nica de la pared intestinal intacta depende principalmente del tejido conectivo
fibroso localizado en la submucosa26 y constituido en su mayor�a de
col�gena es el �nico plano capaz de soportar las suturas, de aqu� su enorme importancia
quir�rgica.
El proceso de curaci�n de una anastomosis,
significa que entre ambos bordes se entrelacen puentes de tejido fibroso. Con el tiempo la
col�gena contenida en �l se convertir� en factor determinante de la resistencia
anastomotica26, 27. Por esta raz�n los estudios est�n encaminados a
determinar que sucede con la col�gena preexistente y que factores influyen en la
formaci�n de la nueva para poder manejar posibles mecanismos de complicaciones.
Durante los primeros 3 a 4 d�as que siguen
a una anastomosis intestinal y durante la llamada fase inflamatoria, la integridad de ella
depende totalmente de la sutura y del sello de fibrina que evita cualquier tipo de fuga
por la l�nea de sutura. Suturas defectuosas pueden ser una causa rara de dehiscencia
anastom�tica. Escogiendo una adecuada sutura que mantenga su fuerza t�nsil y la
realizaci�n de parte del cirujano de nudos seguros pueden eliminar ese problema28,
29. la fuerza tensional inicial de la anastomosis y su p�rdida a trav�s del tiempo
es similar en el es�fago, duodeno y colon excepto el intestino delgado cuya p�rdida es
menor30, esto implica que pueden existir diferencias en la calidad del tejido
conectivo con la que se reparan las distintas regiones intestinales, especialmente cuando
se compara la curaci�n entre el �leon y el colon donde se han observado diferencias en
el tiempo de cicatrizaci�n, la secuencia y magnitud de los cambios bioquimicos31.
As� por ejemplo se ha observado que la col�gena contenida en la l�nea anastom�tica se
deposita en forma m�s temprana en el colon que en el intestino delgado. Cabe mencionar
que el plano mucoso a todo nivel del tracto gastrointestinal es reparado por migraci�n e
hiperplasia de las c�lulas epiteliales para cubrir el defecto. Esta acci�n de las
c�lulas epiteliales cubriendo el tejido de granulaci�n y formando una barrera biol�gica
para el contenido intestinal posiblemente inhibe la inflamaci�n y el crecimiento excesivo
de tejido conectivo que podr�a obstruir la anastomosis39. La curaci�n de las anastomosis
se realiza generalmente por primera intenci�n pero, su mucosa puede cicatrizar por
segunda intenci�n.
Todo cirujano conoce que el tiempo m�s
cr�tico de la integridad de una anastomosis es durante los primeros d�as del
postoperatorio debido a una p�rdida de cohesi�n en el borde del intestino anastomosado29,
30, Esa p�rdida se ha sugerido es producido por un aumento de la actividad
colagenol�tica en el borde adyacente a la anastomosis en el orden del 25% en el tercer
d�a del postoperatorio27. En estos estudios, la cantidad de col�gena fue
determinada por la concentraci�n de hidroxiprolina. Es necesario explicar, que la
concentraci�n de hidroxiprolina no necesariamente representa la cantidad real de
col�gena ya que est� influenciada por cambios en las prote�nas o acumuladas como parte
del proceso inflamatorio normal27, 31. Por lo tanto la p�rdida temprana de la
integridad del borde intestinal anastom�tico debe ser estudiada mas profundamente ya que
los estudios actuales no correlacionan la cantidad de col�gena o los cambios de la
solubilidad con dicha p�rdida y debe prestarse mucho m�s atenci�n a los cambios
estructurales a la que son sometidas las fibras de col�gena durante el proceso, algo que
no se puede revelar con los m�todos de laboratorio actuales.
Un importante fen�meno que altera la
cicatrizaci�n est� relacionada directamente con los neutrofilos que se acumulan de
manera temprana en los bordes de la herida. Experimentalmente en ratas la administraci�n
de suero antineutrofilos evita que la anastomosis pierda su fuerza t�nsil durante los
primeros d�as del postoperatorio32, por lo cual Se sugiere que la presencia de
radicales libres de oxigeno o proteinasas mediadas por los neutrofilos causan degradaci�n
de las fibras de col�gena, disminuyendo la fuerza tisular de la uni�n. Se considera
entonces, que cuando ocurren complicaciones en la anastomosis como la dehiscencia, o
fugas, estas son causadas por infecci�n local o por trauma que son los factores que
aumentar�an la cantidad de neutrofilos alrededor de la anastomosis y causar�an la
degradaci�n excesiva de col�gena. Por el contrario, los inhibidores de las proteinasas y
los liberadores de radicales libres de ox�geno tienen un efecto ben�fico en mantener la
fuerza de cohesi�n sobre los bordes de la herida en forma temprana.
Resumiendo se puede decir que la
disminuci�n de la fuerza en una anastomosis es caracter�stica de los pacientes
traumatizados durante los primeros d�as que siguen a la operaci�n, que es donde se
observan la mayor parte de las complicaciones anastom�ticas. A partir del tercero y
cuarto d�a del postoperatorio se observa un notable aumento en la s�ntesis de col�gena
que rodea a la anastomosis32, 33, 34, ganando esta r�pidamente fuerza mientras
que las suturas pierden la capacidad de mantener juntos los bordes de la pared Intestinal 27,
35, 36, 37. Siendo estas innecesarias 1 o 2 semanas despu�s del procedimiento.
As�, los hilos modernos sint�ticos reabsorbibles pueden ser usados con toda seguridad.
Estudios realizados por Van Winkle et al38 en perros demostraron que la fuerza
de la anastomosis en el colon despu�s de 14 d�as del procedimiento ten�a una
resistencia de 45% al de la pared intestinal intacta y manten�a siendo s�lo del 70% del
normal despu�s de los cuatro meses.
Aunque todav�a existen muchos estudios
contradictorios, es �til seguir pensando que la integridad de una anastomosis depende del
estrecho balance que existe entre la s�ntesis y la lisis de las fibras de col�gena. Este
equilibrio est� influenciado por una gran cantidad de factores, muchos de los cuales son
todav�a desconocidos.
3.1.- Factores que act�an sobre las
Anastomosis
Para tener un orden l�gico de estos
factores, en la literatura m�dica a menudo han sido divididos ampliamente como: factores
sist�micos, factores locales y factores t�cnicos. Los estudios experimentales y
cl�nicos se han enfocado en determinar estos factores en forma aislada tratando de
encontrar la relaci�n existente entre aquellos y las complicaciones.
Factores Sist�micos.-
a) Edad.- Entre los factores
sist�micos que colaboran en las complicaciones de las anastomosis, uno de los m�s
importantes es la edad, 17, 39, 40, 41 cl�nicamente se ha demostrado
que la incidencia de dehiscencia en las anastomosis col�nicas entre pacientes del grupo
etario entre 60-80 a�os ha sido presentada tan alta como en el 22%, 41 y su
causa podr�an ser multifactoriales incluyendo la desnutrici�n, ateroesclerosis,
trastornos cardiocirculatorios y la cohexistencia de malignidad.
b) Desnutrici�n.- La desnutrici�n
como factor de dehiscencia y fuga anastom�tica fue inicialmente reconocido en 1948 por
Localio, Chassin y Hinton42. La hipoproteinemia ha sido asociada
cl�nicamente a un aumento de frecuencia de las complicaciones anastom�ticas despu�s de
la cirug�a del colon41. A pesar que los estudios realizados han fallado en demostrar el
rol que desempe�a la nutrici�n, y que la cantidad de col�gena permanece inalterable a
pesar del uso de la hiperalimentaci�n y que en ratas sometidas a ingesta pobre en
prote�nas, s�lo se observa disminuci�n de la fuerza t�nsil de la anastomosis en
aquellos animales con m�s de 7 semanas de dieta44. Si extrapolamos estos
hallazgos cl�nicamente concluiremos que grados menores de depleci�n proteica por corto
tiempo no tendr�a ning�n efecto en la presentaci�n de complicaciones anastom�ticas.
Por otro lado, est� demostrado completamente que en resecciones esof�gicas donde la
mayor parte de pacientes son desnutridos, la introducci�n de la alimentaci�n parenteral
ha mejorado significativamente su morbinortalidad.
Adem�s de la deficiencia de prote�na, la
de vitaminas tiene tambi�n importancia, especialmente la vitamina "C" o
"�cido asc�rbico por ser un importante cofactor en la conversi�n de la prolina en
hidroxiprolina45 parte constituyente de las fibras de col�gena. La vitamina
A ha sido asociada a efectos ben�ficos durante la cicatrizaci�n de las anastomosis
del colon46, especialmente cuando los pacientes han necesitado irradiaci�n47, 48.
Experimentalmente, la deficiencia de Zinc reduce la actividad de polimorfonucleares,
macr�fagos y tambi�n reduce la multiplicaci�n de fibroblastos, la hiperplasia y la
s�ntesis de col�gena. Los efectos de estas sustancias en la cicatrizaci�n intestinal no
han presentado tener diferencias estad�sticamente significativas49.
c) Terapia con esteroides.- En la
practica cl�nica, los niveles terap�uticos de esteroides no parecen tener influencia en
la curaci�n de las anastomosis intestinal. Sin embargo experimentalmente peque�as dosis
de esteroides en combinaci�n con menores grados de desnutrici�n tiene un efecto adverso
en la formaci�n de col�gena. El efecto delet�reo de los esteroides en la curaci�n de
las heridas puede ser revertido con la administraci�n de vitamina A50.
d) Defectos metab�licos.- La diabetes
Mellitus tiene una influencia indirecta delet�rea sobre la cicatrizaci�n de las
anastomosis por su efecto sobre la disminuci�n de la perfusi�n microvascular de los
bordes y todos los otros procesos relacionados con la hiperglicemia especialmente si esta
se encuentra sin control. En presencia de un paciente controlado, la frecuente de
complicaciones de las anastomosis no tiene diferencia estad�stica significativa con los
normales51.
La uremia experimentalmente tiene
efecto negativo sobre la cicatrizaci�n. Pero sus efectos no han sido vistos cl�nicamente
con detalles. La ictericia produce un notable retraso en la fibroplastia y en la
formaci�n de nuevos vasos sangu�neos, reportado en experimentos sobre �l estomago de
animales52. La hipoxia tiene un notable efecto negativo sobre las
anastomosis y esta depende de un adecuado flujo de sangre arterial oxigenada. El ox�geno
es un elemento importante para la vida y en la cicatrizaci�n participa activamente en la
hidroxilaci�n de la lisina y prolina en la s�ntesis de col�gena, se ha relacionado que
la producci�n de ella es proporcional55 al nivel de Po2 . El efecto
general de la hipoxia es retardar la angionesis y la epitelizaci�n. La hiperoxigenaci�n
en experimentos sobre ratas aparentemente no tiene ning�n efecto sobre la cicatrizaci�n
de las anastomosis sin complicaci�n o isqu�micas.
La anemia, asociada a una p�rdida
aguda de sangre tiene consecuencias negativas en la cicatrizaci�n y aunque la volemia sea
restituida la fuerza t�nsil de la anastomosis no se recupera y el peligro de dehiscencia
es elevado. La necesidad de transfusiones intraoperatorias ha sido presentada como un
factor importante de las fallas anastom�ticas39, al producir una reducci�n de la
viscosidad sangu�nea por hemodiluci�n ya que ella mantiene las tensiones de ox�geno en
condiciones normales en los bordes intestinales. En cambio la anemia normov�lemica
no tiene efecto alguno sobre la curaci�n53, 54. La cicatrizaci�n de las
anastomosis aparentemente no son afectadas por sepsis56 o por trauma distante57.
Factores Locales
a) Trauma.-
Los efectos adversos del
trauma en la cicatrizaci�n del tracto gastrointestinal puede estar relacionado localmente
a la perfusi�n tisular el cual el colon es particularmente sensible a los cambios de
volumen sangu�neo; una reducci�n del 10%, puede reducir la perfusi�n colonica58
a m�s del 30%. El trauma local relacionado a la extirpaci�n de tumores fijos y grandes
est�n muy relacionados a fallas anastom�ticas59 al igual, la cirug�a
motivada por injurias del colon est� asociada a disminuci�n en la capacidad de
cicatrizaci�n produciendo con frecuencias fugas y dehisencias. Mientras tanto el trauma
producido a distancia, tiene muy poco efecto negativo sobre las anastomosis27.
b) Infecci�n.- Todav�a permanece
incierto saber si la infecci�n adyacente a una anastomosis intestinal es la causa o el
efecto de la misma60. Por estudios cl�nicos y experimentales se conoce que la
sepsis peritoneal tiene un efecto negativo en los bordes intestinales por una actividad
colagenol�tica aumentada, el mismo que puede contribuir a la falla de la anastomosis. La
resecci�n y anastomosis primaria en presencia de una enfermedad diverticular perforada,
s�lo podr� realizarse si la infecci�n es localizada, Si existe una diseminaci�n de la
infecci�n, un tercio de las anastomosis fallar�n.
c) Carga fecal.- Las materias
fecales son las sustancias m�s contaminantes del organismo ya que aproximadamente el 50%
del material seco esta conformado por bacterias. El efecto negativo que tienen las heces
en la cicatrizaci�n es un hecho comprobado en las anastomosis colonicas. El mecanismo
exacto del porque lo produce no est� del todo explicado, una posibilidad es que las heces
el bolo fecal distienda la anastomosis y cause que las suturas corten el d�bil borde de
la anastomosis durante las fases tempranas de la cicatrizaci�n. Irving y Goligher41
presentaron una incidencia de dehisencias ansastomoticas del 24% cuando el colon estaba
mal preparado versus un 7% cuando se lo preparaba correctamente.
d) Obstrucci�n.- Las anastomosis
que se realizan en un colon obstruido, est� propenso a complicarse. En el trabajo
presentado por Anderson y Lee61 encontraron que 30% de los pacientes que
tuvieron resecci�n y anastomosis primaria desarrollaron f�stulas fecales. Sin embargo
Las complicaciones presentadas en las anastomosis de colon obstruido en el colon izquierdo
son menos peligrosas que en el derecho y alcanzan estas �ltimas hasta un 23% de
mortalidad cuando la operaci�n es una hemicolectom�a de Emergencia62. Los
problemas de cicatrizaci�n en las obstrucciones intestinales, est�n m�s relacionados a
una alteraci�n del riego sangu�neo, carga fecal y cambios en la flora bacteriana que a
las alteraciones de la colagena, as� vemos que Jiborn63 comprob�
experimentalmente que la s�ntesis de colagena estaba notablemente incrementada en la
pared intestinal en aquellos animales con dilataci�n colonica despu�s de resecci�n de
colon izquierdo en comparaci�n con aquellos que evolucionaron con normalidad.. Siendo
as�, la falla de la anastomosis se realizar�a s�lo en un peque�a �rea como resultado
de la necrosis por isquemia de la l�nea de sutura la que es suficiente para llevar al
paciente a complicaciones dram�ticas como la fuga anastomotica y la dehiscencia con la
consecuente sepsis y fallo multi�rganico.
e) Drenes.- El papel que juegan los
drenajes en aquellos pacientes a los que se ha realizado una anastomosis no tiene un
consenso general unificado.
Se ha sugerido que la acumulaci�n de
exudado junto a la sutura la debilita y puede producirse una dehiscencia, sin embargo como
lo demostr� Goligher et al63 el drenaje presacro en las anastomosis
colorectales no disminuy� la frecuencia de dehiscencia. Experimentalmente se ha
demostrado que los drenes y especialmente los de l�tex producen un incremento sustancial
en la incidencia de dehiscencia de las anastomosis mientras que los drenes de succi�n
pueden causar da�o en los intestinos64. Resumiendo, no existe evidencia
convincente que actualmente sugiera alguna ventaja en el uso de drenes65.
f) Radioterapia.- Es un m�todo
utilizado para tratamiento del c�ncer, puede ser aplicado en preoperatoria o
postoperatoria y su relaci�n con perforaciones intestinales espont�neas es bien
conocido. Cuando se realiza una anastomosis en un intestino previamente irradiado, la
fuerza de la anastomosis est� muy comprometida ya que los cambios tisulares incluyen
fibrosis, obstrucci�n e isquemia por hialinizaci�n de los vasos sangu�neos lo que
altera el balance de la colagena.
Factores T�cnicos
Como hemos venido recordando, la
cicatrizaci�n de las heridas asume un rol significante cuando se trata de la cirug�a del
tracto gastrointestinal porque sus complicaciones se acompa�an de una morbi-mortalidad
seria y significativa. Cualquiera de los factores referidos arriba tienen influencia
negativa en la cicatrizaci�n pero existe cada vez m�s adeptos a pensar que la
experiencia y la habilidad del cirujano es la variable determinante m�s importante en el
�xito o falla de las anastomosis intestinales66, 67.
Conservar una buena irrigaci�n en las
bocas anastom�ticas, Evitar la tensi�n en la l�nea de sutura y asegurar una completa
inversi�n de los bordes mucosos del intestino adem�s de escoger el material adecuado de
sutura son factores t�cnicos sencillos pero que requieren de un buen juicio y experiencia
quir�rgica para su correcta aplicaci�n.
a) Evitar la isquemia del borde.- El
fracaso o �xito de las anastomosis. est� directamente relacionado con la irrigaci�n
sangu�nea de sus bordes. La hemostasia del borde antes de realizar la anastomosis debe
ser perfecta especialmente en las resecciones del est�mago el cual tiene abundante
irrigaci�n, pero esa hemostasia no debe ser realizada a expensa de la isquemia. Otra
manera de conservar la irrigaci�n del borde es que al momento de cortar el intestino
siempre debe hacerse con el bistur� y no con la hoja del electrobistur� y de ser posible
debe verse sangrar libremente los bordes. La isquemia tambi�n se previene cuando ligamos
los vasos del mesenterio bajo transiluminaci�n y evitamos nuevamente el uso del
electrobistur� cerca del la l�nea de sutura.
El uso de las pinzas de coprostasis deben
ser utilizadas durante el menor tiempo posible y no deben sujetar el mesenterio. Si se
tiene confianza de que la preparaci�n mec�nica intestinal es perfecta y se ha
administrado antibi�ticos profil�cticos puede obviarse el uso de la pinza de coprostasis
pero siempre tomando las precauciones necesarias para evitar la contaminaci�n del campo
quir�rgico con la colocaci�n de compresas debajo de la sutura. Evitar la tensi�n de la
l�nea de sutura es una condici�n importante especialmente en las anastomosis del colon
condici�n que se previene con una buena y adecuada movilizaci�n del intestino. Esta
situaci�n es rara que ocurra en el intestino delgado porque su mesenterio es muy
complaciente.
b) Inversi�n de los bordes.- es
importante para obtener una anastomosis segura invertir la mucosa en la l�nea de sutura,
situaci�n exitosa que ha sido comprobada en estudios experimentales68 y
cl�nicos69. Parece ser que la ausencia de una l�nea continua de peritoneo y
la eversi�n de la mucosa es un factor importante de orden t�cnico que favorece la
dehiscencia. La t�cnica utilizada por los cirujanos para invertir la mucosa puede variar:
algunos lo realizan en un s�lo plano el cual en cada punto incluye todas las capas del
intestino excepto la mucosa, esta t�cnica es referida en algunos textos como seromuscular
o serosubmucosa. Las ventajas de esta sutura es que produce muy poco disturbio en la
irrigaci�n de los bordes y adem�s Las ventajas de esta sutura es que produce muy poco
disturbio en la irrigaci�n de los bordes y adem�s permite mantener una anastomosis m�s
amplia que la confeccionada en dos planos. La forma convencional de uni�n es realizarla
en dos planos, usando catgut cr�mico en sutura continua en el primer plano anterior y
posterior y en el segundo plano una sutura interrumpida seromuscular de seda.
c) El material de sutura.- El uso
especifico del material de sutura depende de la preferencia de los cirujanos pero el
catgut cr�mico se ha mantenido preferentemente a pesar que te�ricamente tiene sus
desventajas como el de promover la inflamaci�n y favorecer secundariamente a la
infecci�n el catgut es usado para realizar la sutura continua del plano interno cuando se
utiliza sutura en dos planos, colocando un plano seromuscular de seda para el segundo
plano.
Cuando se utiliza un s�lo plano, se
prefieren los materiales no absorbibles como la seda. Otros materiales usados
corrientemente son el �cido Poliglycolico (Dexon�), Poliglactin (Vicryl�) o
polidioxanona (PDS�). Las anastomosis requieren como soporte las suturas en un tiempo
limitado de aproximadamente 10 d�as a partir del cual la fuerza tens�l de la anastomosis
es dependiente de la formaci�n de col�gena nueva y no del material de sutura.
Desde hace algunos a�os los cirujanos
tenemos la opci�n de utilizar aparatos mec�nicos para las anastomosis cuya seguridad y
velocidad en su confecci�n ha sido extensamente comprobada sin embargo no han demostrado
ser mas seguras que aquellas realizadas a mano aunque son excelentes para realizar
anastomosis en sitios de dif�cil accesos como en el es�fago y recto bajo.
Las t�cnicas de anastomosis sin sutura han
progresado muy lentamente excepto por el anillo biofragmentable70 Valtrac�.
Este aparato est� compuesto por un pol�mero de �cido polyglycolico y sulfato de bario.
El anillo es asegurado con una sutura en bolsa de tabaco con PDS� para crear una
anastomosis de bordes invertidos. El aparato se fragmenta y elimina en un tiempo
aproximado de 16-23 d�as.
Estudios recientes han sugerido que las
anastomosis intestinal pueden ser creadas por soldadura con rayos laser71, 72
siendo un adelanto sustancial en el avance tecnol�gico del rayo l�ser.
4.-T�cnica Anastom�tica Manual en
Cirug�a Gastrointestinal
Casi todos los segmentos del tracto
digestivo tienen similares planos: mucoso; submucoso; muscular y seroso por tal
circunstancia las suturas deber�an ser id�nticas en todos sus niveles. Pero esto no es
as�, los diferentes segmentos var�an en la constituci�n e importancia de sus capas.
Halsted en 1887 escribi� un conocido
art�culo desde el cual se han derivado muchos principios usados actualmente en las
anastomosis intestinales. Uno de los m�s importantes es el reconocer que la submucosa
forma el esqueleto de la pared intestinal y es el �nico plano capaz de soportar los
puntos de sutura sin sufrir desgarros de aqu� la importancia de conocer los puntos
d�biles y fuertes de cada segmento para realizar una sutura que cumpla con sus
principios.
Aunque las suturas intestinales han sido
realizadas desde hace cientos de a�os y algunas de forma anecd�tica como el usar pinzas
de hormigas gigantes para unir los bordes, la edad moderna de las anastomosis empez� con
el trabajo de Travers a inicio del �ltimo siglo recomendando la anastomosis
termino-terminal del intestino con los bordes evertidos. Lembert modific� esta
t�cnica invirtiendo los bordes cortados del intestino usando puntos de colchonero sobre
la serosa. Al finalizar el siglo XIX, Connell describi� la sutura continua que
invert�a los bordes y que a�n mantiene su nombre. Por �ltimo aparece Czerny que
recomend� hacer todo cierre intestinal en dos planos. Por lo tanto la forma de
anastomosis preferida por muchos cirujanos es la termino-terminal de Travers, realizando
la uni�n en dos planos de Czerny usando una sutura continua que invierte los bordes a lo
Connell para el plano interno y una sutura seromuscular de Lembert para el plano externo.
A pesar de las influencias desfavorables,
las suturas gastrointestinales suelen ser resistentes, esto gracias a la plicabilidad y
resistencia propias de los tejidos. El objetivo de una sutura gastrointestinal es
proporcionar el cierre herm�tico de una v�scera o de su anastomosis con otra.
4.1.- Caracter�sticas Quir�rgicas de
los Segmentos
1.- Es�fago.- Las condiciones
quir�rgicas de este �rgano son de las peores para realizar anastomosis, su acceso
quir�rgico es dif�cil, la irrigaci�n es muy pobre, el plano muscular d�bil y la
submucosa fina, por estas razones la prevenci�n de las fugas y el desgarro de las suturas
depende casi totalmente del plano mucoso que como hemos visto no es el mejor. Las fugas
anastom�ticas del es�fago representan la m�s alta incidencia de mortalidad en la
cirug�a del es�fago raz�n por la cual las anastomosis intrator�cicas deben ser
evitadas porque una fuga a este nivel tiene consecuencias desastrosas para el paciente y
deben preferirse las uniones en el es�fago cervical.
En el es�fago y el recto extraperitoneal
son los sitios donde preferentemente deben usarse suturadores mec�nicos por la facilidad
con la cual se realizan. Las suturas manuales son m�s sencillas de realizarlas en estos
sitios cuando se realizan en forma interrumpida tomando la totalidad de los planos usando
material de sutura adecuado y procurando que la mucosa de ambos bordes quede en perfecta
oposici�n. La inversi�n de la mucosa debe ser m�nima para evitar las estenosis y la
sutura, excepto cuando se usan los staples, deben realizarse sobre la sonda nasogastrica
en su lugar. Una radiograf�a con gastrografina o cualquier sustancia radiopaca
hidrosoluble debe realizarse entre el 5 y 6 d�a para confirmar la integridad de la
anastomosis.
2.- Est�mago.- Su gruesa capa
muscular, y su gran irrigaci�n hacen que la hemorragia en la l�nea de sutura sea uno de
los principales riesgos durante una resecci�n o gastrotom�a por esto es deseable siempre
realizar una sutura continua de todos los planos, de manera preferente reforz�ndolo con
un segundo plano seromuscular. Los aparatos mec�nicos son tambi�n excelentes para hacer
la nueva curvatura menor, cerrar el duodeno y construir la anastomosis Billroth I o
Billroth II ahorrando tiempo en forma significativa. El problema es el costo y mientras no
se logre hacerlo m�s barato, la sutura manual que ha tenido tanto �xito en los cirujanos
entrenados seguir� siendo ejecutado por nuestros cirujanos por mucho tiempo.
3.- Intestino Delgado.- Es uno de
los segmentos m�s nobles para realizar suturas y anastomosis termino-terminal,
termino-lateral, o latero-lateral. Es una de las primeras anastomosis que realiza el
cirujano en entrenamiento por su baja incidencia en fugas y dehiscencias. Usualmente se
utilizan en la anastomosis dos planos el primero continuo en la pared anterior y
posterior, seguido por uno invaginante. Los suturadores mec�nicos tienen muy poca cabida
en este segmento.
4.- Colon.- El colon ha sido uno de
los segmentos intestinales que mayores temores produce en los cirujanos, debido a su
contenido altamente contaminante, en el caso de presentarse fugas anastom�ticas. Las
anastomosis de este segmento suelen realizarse en dos planos, un interno invaginante que
puede ser perforante o extramucoso y un externo seromuscular de refuerzo, los materiales
de sutura suelen ser reabsorbibles, especial cuidado se debe tener con mantener la
irrigaci�n del borde anastom�tico y de evitar la tensi�n de la sutura.
Las suturas mec�nicas han tenido un
importante aporte en la realizaci�n de las anastomosis rectales muy bajas, que producen
una anastomosis invaginante, directa, t�rmino-terminal y circular que no hubiera sido
factible con t�cnicas manuales.
Debemos anotar que en todas las anastomosis
gastrointestinales existen estudios que demuestran la factibilidad de realizarlas con un
solo plano de suturas, el mismo debe ser realizado con todo el cuidado t�cnico y siempre
debe primar la experiencia del cirujano, ya que el objetivo es lograr una sutura
confiable, que garantice la seguridad y la funcionalidad de las anastomosis.
4.2.- Materiales de Sutura
Los diversos materiales de sutura se
utilizan en funci�n de distintas razones, aunque el catgut ha sido muy �til durante
mucho tiempo, presenta algunas fallas, como su resistencia variable y su reabsorci�n
impredecible, dadas estas fallas desde 1960 comenz� la b�squeda de una sustancia
sint�tica que pudiera ser reabsorbida o degradada por los tejidos en un tiempo razonable,
que no fuera t�xico, que pudiera fabricarse en forma de una fibra fuerte de anudamiento
f�cil y que pudiera ser esterilizable sin alteraci�n de sus calidades f�sicas y
propiedades biol�gicas.
Reci�n desde la d�cada de los 70 se
introdujo las primeras suturas sint�ticas absorbibles, derivadas de un pol�mero del
�cido poliglic�lico, los primeros estudios demostraron que estas suturas ten�an un
comportamiento igual al del catgut cromado, sin los efectos secundarios de ese material.
Desde 1977 en que Laufman y Rubel
publicaron una excelente revisi�n general del desarrollo de las suturas sint�ticas
absorbibles, estas han ganado el favoritismo de los cirujanos, m�s a�n dada la
persistencia de su resistencia y la baja reactividad tisular, se est�n aplicando en lugar
de las no absorbibles, lo cual permite al cirujano utilizar, en toda la operaci�n,
suturas sint�ticas absorbibles de varios tama�os, en ves de diferentes materiales.
El comportamiento final de las suturas
intestinales difiere de acuerdo a su localizaci�n. Las suturas absorbibles que penetran
la mucosa sufren una r�pida desintegraci�n, las no absorbibles, que atraviesan todas las
capas y que quedan expuestas a la luz intestinal pueden algunas veces ser expulsadas al
tubo digestivo. Las suturas no absorbibles, que no ingresan a la luz intestinal, siguen
sumergidas en forma parcial o total, de acuerdo con la t�cnica utilizada, las suturas
absorbibles se comportan como las no absorbibles hasta que comienza su absorci�n, momento
en el que se produce una reacci�n inflamatoria que persiste hasta que la sutura ha sido
absorbida, las suturas monofilamento son las menos reactivas.
4.3.- Agujas
En las suturas intestinales se requiere que
las agujas utilizadas sean redondas en su cuerpo y hasta su punta, ya que el orificio
redondo utilizado por estas agujas se cierra con seguridad con el material de sutura y no
da�an otras suturas colocadas con anterioridad.
La aguja no debe tener un di�metro mayor
que el hilo que arrastra a fin de que este llene en forma total el conducto creado por la
aguja.
5.- Suturas Mec�nicas
5.1.- Generalidades
La importancia de la invaginaci�n del
intestino y de la aproximaci�n serosa-serosa, la se�alo Lembert, aunque indic� que la
excesiva invaginaci�n favorec�a la obstrucci�n intestinal. Este principio qued�
establecido firmemente para las anastomosis intestinales, es decir el cierre con
invaginaci�n mucosa y aproximaci�n de las serosas, sin embargo Travers comentaba que era
mucho lo que se hab�a hecho con las t�cnicas para la anastomosis intestinal y que si las
suturas se colocaban en forma apropiada, cualquiera que fuera la t�cnica utilizada, la
cicatrizaci�n se produc�a. Travers hab�a dado directivas para realizar anastomosis
evertidas muco-mucosas.
El uso de suturas mec�nicas se inicia con
Henroz, que public� el uso de anillos gemelos que conten�an agujas y orificios
alternativos, que pod�an ser colocados por fuera del intestino y luego calzar uno contra
el otro a trav�s de los bordes evertidos de los dos extremos intestinales, este aparato
es el precursor del bot�n de Murphy que consiste en dos cilindros huecos, que se
telescopan y que presentan una cabeza en forma de hongo en cada extremo, de tal modo que
cada zona terminal del intestino puede ser contenida dentro de una especie de jareta en
cada cabeza del aparato, que luego se une mediante un telescopaje comprimiendo los bordes
intestinales.
Desde estos primeros trabajos las suturas
mec�nicas del aparato digestivo van constituyendo una variante de las tradicionales
t�cnicas manuales, variaciones que se dan en ciertas caracter�sticas especiales como los
cierres muco-mucosos con suturas evaginantes, el uso de suturas met�licas, la aplicaci�n
de equipos mec�nicos y la velocidad con que se pueden efectuar anastomosis casi cerradas,
diminuyendo la potencial contaminaci�n.
5.2.- Historia
En 1921 Aladar de von Petz presenta en
Hungr�a un instrumento, que consist�a en una pinza gigante de Payr, que transportaba dos
filas de ganchos construidos de plata, que se cargaban con la mano y que en forma
secuencial iban penetrando en los tejidos mediante la rotaci�n de una rueda. El trabajo
de von Petz se baso en el instrumento de su maestro Humer H�ltl que de hecho fu� el que
introdujo las suturas mec�nicas, si bien es cierto que en un inicio se lo utiliz� s�lo
para el cierre temporal de viseras, cuyo extremo engrampado era luego invaginado en la
forma convencional, Meyer en Nueva York refiri� el uso de este instrumento para la
construcci�n de un tubo de BecK-Jianu para el reemplazo del es�fago tor�cico.
Friedrich logra uno de los avances m�s
importantes al introducir cartuchos intercambiables donde pod�an ser recargados a mano
los ganchos, permitiendo el uso repetido del mismo instrumento durante la cirug�a. Es en
Mosc� donde se presenta un fuerte impulso al desarrollo de instrumentos de sutura
mec�nica, el primer instrumento parece haber sido creado por Gudov para las anastomosis
vasculares, se desarrollaron toda una gama de grampas, instrumentos para el cierre del
aparato digestivo, para las anastomosis muco-mucosas con invaginaci�n o para las suturas
sero-serosas de asas contiguas de intestino delgado as� como otros instrumentos para el
cierre y secci�n del est�mago.
En la actualidad los instrumentos se
caracterizan por su construcci�n funcional, la provisi�n de cartuchos precargados,
esterilizados y descartables, de colores codificados, con partes m�viles delicadas, con
hojas cortantes incorporadas que convierten al instrumento en un equipo simple.
5.3.- Equipos para Suturas Mec�nicas
Para las operaciones sobre el aparato
digestivo se dispone en la actualidad de cuatro equipos b�sicos para suturas mec�nicas:
TA, GIA, LDS Y EEA.
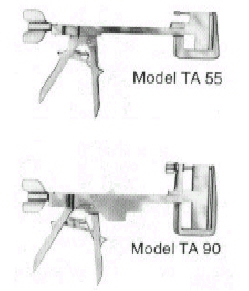
a) TA (Toracoabdominal): Este instrumento
consiste en dos ramas en L acopladas: las ramas verticales, m�s largas, se deslizan una
sobre la otra cuando se rota un tornillo ubicado en la cabeza del instrumento, con lo que
se aproximan las ramas horizontales; en la rama superior se encuentra el cartucho
removible con ganchos y en la inferior est� el yunque que da la forma definitiva a las
grampas. Las ramas se aproximan hasta que una escala de medici�n (Vernier) ubicada sobre
ambas ramas verticales, indica que los tejidos han alcanzado cierto grado de compresi�n.
Estos aparatos se utilizan para el cierre terminal o tangencial muco-mucoso. Los colores
codificados indican la altura de los ganchos utilizados para las suturas de tejidos de
diferente espesor.
|
 |
|
Fig.
1.- TA |
b) GIA (Anastomosis Gastrointestinal):
Presenta dos ramas delicadas y largas, que transportan el cartucho de ganchos y el yunque
descartable. Se presenta en dos tama�os, uno sirve para crear una l�nea de ganchos de
5.5 cm y el otro origina una l�nea de ganchos de 9 cm. El sistema activo consiste en dos
barras y una hoja central, las barras externas conducen las dos hileras de ganchos y la
hoja cortante central se encuentra a cierta distancia de los ganchos y por detr�s de
ellos.
Cuando las dos mitades del instrumento
est�n acopladas y fijas y el sistema es activado, se introducen dos hileras de ganchos
alternantes que unen los extremos intestinales por suturar mientras que la cuchilla
secciona los tejidos existentes entre las dos hileras de ganchos.
Cuando se lo inserta a trav�s de peque�os
orificios labrados en asas contiguas apuestas, el instrumento las une y crea una
anastomosis al mismo tiempo.
|
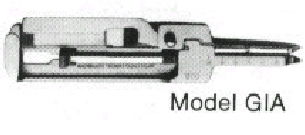 |
|
Fig.2.-GIA |
c) LDS (Ligadura y Secci�n): Este
instrumento coloca dos ganchos, uno a cada lado de la hoja de la cuchilla, con lo que
produce en forma simult�nea la ligadura y la secci�n de los tejidos ubicados en su punta
que tiene forma de U. Contiene 15 pares de ganchos y puede ser utilizado en forma
repetida.
|
 |
|
Fig.3.-LDS |
c) EEA (Anastomosis T�rmino-Terminal):
Instrumento tubular parecido a un
sigmoidoscopio que en un extremo tiene un mango que sirve para activar el instrumento y
una rosca mariposa que permite aproximar o separar los ganchos del yunque, que est�
ubicado en la otra mitad del cartucho. En el otro extremo, el cartucho descartable se
compone de un cilindro cubierto por un cono hemisf�rico.
Este cilindro contiene el cartucho con sus
dos hileras de ganchos, los empujadores para conducir los ganchos y una cuchilla circular
ubicada justo dentro del anillo formado por las grampas. El cono del extremo contiene el
yunque que dar� forma definitiva a los ganchos y en su interior existe un anillo de
pl�stico resistente sobre el cual la cuchilla debe cortar el doble diafragma formado por
el intestino.
Los segmentos por anastomosar son ajustados
mediante jaretas alrededor del cono y de la zona proximal del cartucho y son aproximados
con vueltas del tornillo del mango. La compresi�n del mango empuja en forma simult�nea
la doble fila de ganchos y la cuchilla circular, que corta el doble diafragma formado por
las dos jaretas anudadas sobre los extremos intestinales, con lo que se crea, en forma
instant�nea una anastomosis t�rmino-terminal invaginante. Los cartuchos tienen un
di�metro de 31, 28,6 25 mm.
|
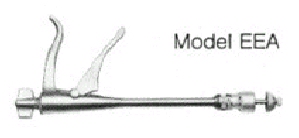 |
|
Fig.4.-
EEA |
5.4.-Suturas Mec�nicas y Cicatrizaci�n
Intestinal
Siempre debemos recordar que las t�cnicas
para las suturas mec�nicas no habilitan al cirujano para abandonar las reglas b�sicas de
la cirug�a, los instrumentos no permiten hacer al cirujano, lo que de otra manera no
podr�a ejecutar con sus manos, no eliminan el necesario entrenamiento quir�rgico y
requieren el aprendizaje de las t�cnicas manuales.
Las grampas o los ganchos modernos que
utilizan acero carecen de reactividad para los tejidos, no se corroen y mantienen su forma
gracias a sus propiedades f�sicas, adem�s no son deformados por la peristalsis y no se
debilitan durante el cierre.
Por su forma permiten que los vasos
penetren a trav�s de sus aberturas y entre ellos permitiendo que los mu�ones permanezcan
viables m�s all� de la l�nea de ganchos. La cicatrizaci�n del intestino seccionado,
suturado en forma mucosa-mucosa con una doble hilera de ganchos alternados, se produce en
forma segura sin necesidad de invaginar o cubrir con tejidos adyacentes, la nutrici�n de
los extremos intestinales fijados con suturas mec�nicas y la cicatrizaci�n de esos
extremos depende de la circulaci�n intr�nseca de la pared intestinal y no de los tejidos
adyacentes.
La comparaci�n macrosc�pica y
microsc�pica de las suturas mec�nicas y las realizadas con maniobras manuales muestra
menor edema, hemorragia o necrosis en aquellas durante los primeros 10 d�as, este es el
momento en que las suturas manuales muestran edema, equ�mosis, desgarros mucosos y
aflojamiento de las suturas que penden en la luz. En experimentos controlados, la
cicatrizaci�n de las anastomosis mec�nicas ha resultado tan confiable como la observada
con las suturas convencionales en dos planos en anastomosis estero-enterales,
entero-c�licas o colo-col�nicas.
5.5.- Complicaciones de las Suturas
Mec�nicas.
Relacionadas con las suturas mec�nicas se
consideran las siguientes complicaciones:
I. Aproximaci�n Inadecuada de los
Tejidos. Puede observarse durante la cirug�a que una parte del borde de secci�n
no ha sido aproximado con los ganchos, por lo que se debe volver a aplicar el instrumento,
o recurrir a la utilizaci�n de suturas manuales para cerrar el defecto. Las disrrupciones
de las anastomosis pueden llevar a complicaciones serias o a la muerte de los pacientes
por lo que se requiere tener total seguridad sobre el cierre de las mismas.
II. Hemorragia. Se pueden
observar hemorragias importantes vinculadas con las suturas mec�nicas y en muchos casos
es necesario colocar puntos adicionales para su control. La hemorragia proveniente del
borde de secci�n de la v�scera resecada que ha sido tratada con suturas mec�nicas se
menciona en diferentes publicaciones y exigi� la colocaci�n de sutura sobre la l�nea de
los ganchos, estas publicaciones consideran que las hemorragias observadas en la l�nea de
sutura con ganchos deben atribuirse en forma directa a la t�cnica utilizada.
III. Falta de Visualizaci�n.
Esto puede conducir a que tratemos inadecuadamente la patolog�a como por ejemplo la
ausencia de observaci�n de una ulcera sangrante en el duodeno o al extirpar un
diverticulo de Meckel con suturas mec�nicas, encontrar mucosa g�strica ect�pica en los
bordes de la pieza de resecci�n.
La inclusi�n inadvertida de estructuras
adyacentes, como por ejemplo la que produce ictericia debido a la inclusi�n del col�doco
en una sutura mec�nica durante la ejecuci�n de una gastrectom�a total.
IV. Fallas T�cnicas. El
funcionamiento defectuoso de los instrumentales puede dar lugar a bloqueos en el mecanismo
de disparo que hace muy dificultosa la extracci�n del aparato, provoca que los ganchos no
sean bien aplicados o falta de disparo de los mismos, requiri�ndose colocar suturas
manuales.
El uso de suturas mec�nicas ha quedado
establecido como un m�todo aceptable para las suturas efectuadas en muchas operaciones
del aparato digestivo, sus �ndices de morbilidad y mortalidad no exceden a los observados
con el uso de suturas manuales, el tiempo operatorio se acorta, los estomas son m�s
amplios y el funcionamiento se efect�a m�s temprano. El uso de suturas mec�nicas reduce
el manoseo de los tejidos.
Pero las suturas mec�nicas no pueden
utilizarse en todos los pacientes o circunstancias y antes de considerar su uso el
cirujano debe tener cierta familiaridad con el uso de estos instrumentos y las t�cnicas
para su adecuada utilizaci�n.
Un aspecto muy importante a considerar es
el elevado costo de las suturas mec�nicas que no permiten su uso en todos los servicios
de cirug�a.
Bibliograf�a
1.- Eastwood. G. Gastrointestinal
Epithelial renewal. Gastroenterology. 72. 962-75. 1977.
2.-Stanley J, Woodley D, katz S, et al:
Structure and function of basement membrane. J Invest Dermatol (Suppl)) 79. 69-72. 1982
3.- Timpl R, Wiedemann H, van delden v,
et al: a network model forr the organisation of type IV collagen molecules in basement
membranes. Eur J Biochem 120. 203-24. 1981
4.- Kanwar Y, Farquar M. Isolation of
glycosaminoglycans (heparan sulfato) from glomerular basement membranes. proc Natl Acad
Sci USA 76. 4493-7. 1979
5.- Gay S, Miller E. Colagen in the
physiology and pathology of connective tissue. New Yorck, Gustav Fisher Verlag, 1978, p.
32
6.- Fulcheri E, Cantino D, Bussolati G.
Presence of intramucosal smooth muscle cells in normal human and rat colon. Basic appl
Histochem. 29. 337-44. 1985
7.- Joice N, Haire M, Palade G.
Morphologic and biochemical evidence for a contractile cell network within the rat
intestinal mucosa. Gastroenterology. 92. 68-81. 1987.
8.- Elson C, Kagnoff F, Fiocchi C. et
al. Intestinal inmunity and inflamation: Recent progress. Gastroenterology. 91. 746-68.
1986
9.- Graham M, Diegelman R, Elson C et
al. Colagen content and types in the intestinal strictures of Crohn's disease.
Gastroenterology 94. 257-65. 1988.
10.- Morton L, Barnes M. Collagen
polymorphism in the normal and diseased blood vessel wall. Investigation of collagens type
I, III and V. Atherosclerosis. 42. 41-51. 1982
11.- Graham M, Drucker D, Diegelmann R
et al. Collagen synthesis by human intestinal smooth muscle cells in culture.
Gastroenterology. 92. 400-05. 1987.
12.- Elstow S, Weiss J. Extraction,
isolation and characterization of neutral salt soluble type V collagen from fetal calf
skin. Coll Rel Res. 3. 181-94. 1983
13.- Narayanan A, Engel L, Page R. The
efefect of chronic inflammation on the composition of collagen types in human connective
tissue. Coll Rel res. 3. 323-34. 1983.
14.- Epstein E, Munderloh H, Isolation
and characterization of human [�1(III)]3 collagen and tissue distribution of [�1(I)]2
�2 and [�I(III)]3 colagens. J. Biol Chem. 250. 9304-12. 1975.
15.- Gabella G. structure of muscles and
nerves in the gastrointestinal tract. In johonson L. Physiology of the gastrointestinal
tract, 2da ed. New York. Raven Press, pp 335-81. 1987
16.- Stromberg B, Klein L. Collagen
dynamics of partial small bowel obstruction. Am J Surg. 148. 257-61. 1984
17.- Debas H, Thomson F. critical review
of colectomy with anastomosis. Surg Ginecol Obstet. 135. 747-52. 1972
18.- Fielding L, Stewart-Brown S,
Blesovsky L et al. Anastomotic integrity after operations for large bowel cancer. A
multicentre study. Br. Med J. 281. 411-4. 1980
19.- Tagart R, Colorectal anastomosis:
Factors influencing succes J. R Soc Med. 74. 111-18. 1981
20.-Goligher J, Graham W, Dombal F.
Anastomotic dehiscence after anterior resection of rectum and sigmoid. Br. J. Surg. 57.
109-18. 1970
21.- Young H, Wheeler M. Results fo a
prospective randomized double-blind trial of aprotinin in colonic surgery. World J Surg 8.
367. 73. 1984
22.- Gunnlaugsson G,Wychulis A, Roland C
et al. Analysis of the records of 1657 patients with carcinoma of the esophagus and cardia
of the stomach. Surg Gynecol Obstet. 130. 997-1005. 1970
23.- Kirkpatrick J, Siegel T,
Gastrojejunal disruptions. Arch Surg. 119. 659-63. 1984
24.- Alden J, Gastric and yeyunal
bypass. Arch Surg. 112. 799-804. 1979
25.- McFarland R, Gazet J, Pilkington T.
A 13 year review of jejunal bypass. Br J Surg 72. 82-7. 1985
26.- Halsted W, Circular suture of the
intestine- an experimental study. Am J Med Sci 94. 436-61. 1887
Peacock E, van Winkle W. The
biochemistry and the enviroment of wounds and their relation to wound strength. In Peacock
Wound Repair. Philadelphia WB Saunders, 1976.
27 Irving T, Hunt T. Reappraisal of the
healing process of anastomoses of the colon. Surg Gynecol Obstet. 138. 741-46. 1974
28.- Howes E, Harvey S. The strength of
the healing wound in relation to the holding strength of the catgut suture. N Engl J Med.
200. 1285-90. 1929
29.- Croning K, Jackson D, Dunphy J.
Changing bursting strength and collagen content of the healing colon. Surg Gynecol Obstet.
26. 747-53. 1968
30.- H�gstr�m H, Haglund U.
posoperative decrease in suture holding capacity in laparotomy wounds and anastomoses.
Acta Chir Scand. 151. 533-5. 1985
31.- J�nson K, Jiborn H, Zederfelt B.
Comparison of healing in the left colon and ileum. Changes in collagen content and colagen
synthesis in the intestinal wall after ileal and colonic anastomoses in the rat. Acta Chir
Scand. 151. 537-41. 1985
32.- H�gstr�m H, Haglund U.
Neutropenia prevents decrease in strength of rat intestinal anastomosis: Partial effect of
oxigen free radical scavengers and allopurinol. Surgery. 99. 716-20. 1986
33.- Young H, Wheeler M, Collagenase
inhibition in the healing colon. J.R Soc Med. 76. 32-6. 1983
34.- Shandall A, Williams G, Hallett M
at el. Colonic healing: A role for polymorphonuclear leukocytes and oxigen radical
production. Br J Surg. 73. 225-8. 1986
35.- J�nson K, Jiborn H, Zederfelt B.-
Breaking strength of small intestinal anastomoses. Am J. Surg 145. 800-03. 1983
36.- Blomquist P, Jiborn H, Zederfeldt
B. The effect of relative bowel rest on healing of colonic anastomoses. breaking strength
and collagen in the colonic wall following left colon resection and anastomoses in the
rat. Acta Chir Scand 150. 681-5. 1984
37.- Herrmann J, Woodward S, Pulaski E.
Healing of colonic anastomoses in the rat. Surg Gynecol Obstet. 119. 269-75. 1964
38.- Van Winkle W, Hastings J, Barker E
et al. Role of the fibroblast in controlling rate and extent of repair in wounds of
various tissues. In Kulonen E, Pikkarainen J. (eds): Biology of Fibroblast. New York,
Academic Press, 1973.
39.-Deveney C, Dunphy J. Wound healing
in the gastrointestinal tract. In Hunt T, Dunphy (eds): Fundamentals of wound Management.
New York, Appleton-Century-Croft. 1979
Schrock T, Deveney C, Dunphy J. Factors
contribuiting to leakage of colonic anastomoses. Ann Surg. 177. 513-8. 1973
40.- Tagart R,. colorectal anastomosis:
Factors influencing succes. J. R. Soc Med. 74. 111-8. 1981
41.- Irvin T, Goligher J. Aetiology of
disruption of intestinal anastomoses. Br. J Surg. 60. 461-4. 1973
42.- Foster M, Leaper D. The alimentary
tract. pp 171.
43.- Daly J, Steiger E, Vars H, Dudrick
S. Postoperative oral and intravenous nutrition. Ann Surg. 180. 709-15. 1974
44.- Irving T, Hunt T. Effect of
malnutrition on colonic healing. Ann Surg 180. 765-71.1974
45.- Irving T. Wound healing. Principle
and practice. London, Chapman and Hall. 1981
46.- Bark S, Rettura G, Goldman D et al.
effects of supplemental vitamin A on the healing of colon anastomoses. J. Surg Res. 36.
470-4. 1984
47.- Winsey K, Simon R, Levenson S et
al. Efect of supplemental vitamin A on colon anastomotic healing in rats given
preoperative irradiation. Am. J Surg. 153. 153-6. 1987
48.- Levenson S, Gruber C, Rettura G et
al. Supplemental vitamin A prevents the acute radiation-induced defect in wound healing.
Ann Surg. 200. 106-24. 1984
49.- Chapvil M. Zinc and other factors
of the pharmacology of wound healing. In Wound Healing, Theory and Surgical practice (Ed)
Hunt, T.K. New York: Appleton-Century Crofts
50.- Ehrlich H, and Hunt T. effects of
cortisone and vitamin A on wound healing. Ann of Surg. 167. 324-8. 1968
51.- Goodson W, Radolf J Hunt T. Wound
healing in diabetes. In Wound healing and wound infection, Theory and Ssurgical Practice
(Ed) Hunt, t, k. New York. Appleton-Centuy Crofts
52.- Bayer I, Ellis H. Jaundice and
wound healing, an experimental study. Br J. Surg. 67. 392-6. 1976
53.- Trueblood H, Nelsen T, Kohatsu S el
al. Wound healing in the colon: Comparison of inverted and everted closures. Surgery. 65.
919-30. 1969
54.- Heughan C, Grislis C, Hunt T. The
effect of anemia on wound healing. Ann Surg. 179. 163-7. 1974
55.- Hunt T, Pai M. The effect of varyng
ambient oxygen tensions on wound metabolism and collagen synthesis. Surg, Gyneco Obstet.
135. 561-7. 1972
56.- H�gstr�m H, Jiborn H, Zederfelt B
et al. Influence of intraperitoneal Escherichia coli with septicemia on the healing of
colonic anastomosis and skin wounds. An experimental study in the rat. Eur Surg res. 17.
128-32. 1985
57.- Irvin T, Hunt T. Pathogenesis and
prevention of disruption of colonic anastomoses in traumatized rats. Br J Surg. 61. 437-9.
1974
58.- Gilmour D, Aitkenhead A, Hothersall
A, Ledingham I. The efect of hypovolaemia on colonic blood flow in the dog. Br. J Surg.
67. 82-4. 1980
59.- Irvin T, Goligher J. Aetiology of
disruption of intestinal anastomoses. Br J Surg. 60. 461-4. 1973
60.- Hawley P, Faulk W, Hunt T et al.
Collagenase activity in the gastrointestinal tract. Br J Surg. 57. 896-99. 1970
61.- Anderson J, Lee D. The management
of acute sigmoid volvulus. Br J Surg. 68. 117-20. 1981
62.- Debas H, Thomson F. A critical
review of colectomy with anastomosis. Surg Gynecon Obstet. 135. 747-52. 1972
62.- Jiborn H, Ahonen J, Zederfeldt B.
Healing of experimental colonic anastomoses. Effects of suture technique on collagen
metabolism in the colonic wall. Am J Surg. 139. 406-13. 1980
63.- Goligher J, Graham N, Dombal F.
Anastomotic dehiscence after anterior resection of rectum and sigmoid. Br j Surg. 57.
109-18. 1970
64.- Benjamin P. Faeculent peritonitis:
a complication of vacuum drainage. Br J Surg. 67. 453-4. 1980
65.- Killingback M. Intrapelvic
restorative resection for carcinoma of the large bowel. Hunterian Lecture, R Coll Surg of
England. 1981.
66.- Fielding L, Stewart B, Blesovsky L,
Kearney G. Anastomotic integrity after operations for large-bowel cancer: a multicentre
study. Br Med J. 281. 411-14. 1980
67.- Matthews H, Powell D, McConkey C.
Effects of surgical experience on the results of resecction for oesophageal carcinoma. Br
J Surg. 73. 621-3. 1986
68.- Irvin T, Edwards J. Comparison of
single layer inverting, two-layer inverting and everting anastomoses in the rabbit colon.
Br J Surg. 60. 453-7. 1973
69.- Goligher J, Morris C, McAdam W,
DeDombal F, Johnston D. A controlled clinical trial of inverting versus everting
intestinal suture in clinical large bowel surgery. Br J Surg. 57. 817-22. 1970
70.- Hardy T, Pace W, Maney J, Katz A,
Kaganov K. A biofragmentable ring for sutureless bowel anastomosis. Dis Colon Rectum. 28.
484-90. 1985
71.- Costello A, Johnson D, Cromeens D,
Wishnow K, Von Eschenbach A, Ro J. Sutureless end-toend bowel anastomosis using Nd:YAG and
water-soluble intraluminal stent. Lasers Surg. Med. 9. 70-3. 1990.
72.- Sauer J, Hinshaw J, McGuire K, The
first sutureless, laser-welded, end-toend bowel anastomosis. Lasers Surg Med. 9. 70-3.
1989.
|